题目内容
19.0.1mol•L-1HIO3溶液加水稀释的图象如下,下列对该溶液叙述正确的是( )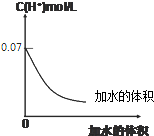
| A. | 若使溶液的pH升高1,可提高溶液的温度加水的体积 | |
| B. | 若使溶液的pH升高1,将溶液稀释到原体积的10倍 | |
| C. | 0.1 mol•L-1HIO3溶液稀释10倍后,溶液中c(H+)>c(IO3-)>c(HIO3) | |
| D. | 加水稀释过程中n(HIO3)+n((IO3-)减小 |
分析 根据0.1mol•L-1HIO3溶液加水稀释的图象,当横坐标为0时,c(H+)=0.07mol•L-1,由此判断HIO3为弱酸,根据弱酸的稀释规律解答该题.
解答 解:根据0.1mol•L-1HIO3溶液加水稀释的图象,当横坐标为0时,c(H+)=0.07mol•L-1,由此判断HIO3为弱酸.
A.电离吸热,提高溶液的温度,促进电离,c(H+)增大,溶液的pH减小,不可能使溶液的pH升高1,故A错误;
B.根据图象起点分析HIO3为弱酸,将溶液稀释到原体积的10倍,溶液的pH升高小于1,故B错误;
C.因水也会电离出H+,且HIO3电离出的H+和IO3-相等,则溶液中始终有c(H+)>c(IO3-),根据图象起点当横坐标为0时,c(H+)=0.07mol•L-1即HIO3电离度为70%,此时c(IO3-)>c(HIO3),当0.1 mol•L-1HIO3溶液稀释10倍后,促进电离,未电离的HIO3比初始时占的比例更少,则溶液中c(H+)>c(IO3-)>c(HIO3),故C正确;
D.根据物料守恒,加水稀释过程中n(HIO3)+n((IO3-)始终不变,故D错误;
故选C.
点评 本题考查了弱电解质的电离,明确加水稀释时促进弱电解质电离及弱酸的稀释规律,再结合平衡移动影响因素来分析解答,难度中等.

练习册系列答案
相关题目
9.下列化学用语正确的是( )
| A. | 羟基的电子式  | |
| B. | F原子的轨道式 | |
| C. | 硫原子的电子排布式 1s22s22p63s23p6 | |
| D. | 氨气的结构式 |
10.相同主族的短周期元素中,形成的单质一定属于相同类型晶体的是( )
| A. | 第IA族 | B. | 第IIIA族 | C. | 第IVA族 | D. | 第VIA族 |
7.生活因化学而精彩,化学因实验而生动,实验因“洗涤”而更加精确.关于沉淀或晶体洗涤的说法错误的是( )
| A. | 洗涤的目的一般是除去沉淀或晶体表面可溶性的杂质,提高纯度 | |
| B. | 洗涤的试剂一般可选用蒸馏水、冰水、乙醇、该物质的饱和溶液 | |
| C. | 洗涤的操作是向过滤器里的固体加洗涤剂,使洗涤剂浸没固体,待洗涤剂自然流下 | |
| D. | 洗净的检验是检验最后一次洗涤液中是否含有形成沉淀的该溶液中的离子 |
4.已知X、Y、Z、W都是短周期元素,它们的原子序数依次递增,X原子的电子层数与它的核外电子总数相等,而Z原子的最外层电子数是次外层的3倍,Y和Z可以形成两种以上气态化合物,W的族序数比X的族序数大1,则下列说法错误的是( )
| A. | Y和Z可以组成一种Y和Z的质量比为7:20的共价化合物 | |
| B. | X,Y、Z可以组成一种盐,其中X、Y、Z元素原子个数比为4:2:3 | |
| C. | Y和W组成的化合物与X和Z组成的化合物反应可生成2种碱性物质 | |
| D. | 由X、Y、Z三种元素中的任意两种组成的具有10电子的微粒有2种 |
11.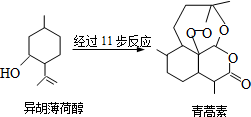 屠呦呦因发明抗疟疾新药青蒿素和双氢青蒿素被授予诺贝尔生理学或医学奖.以异胡薄荷醇为原料是人工合成青蒿素的途径之一(如图).下列说法正确的是( )
屠呦呦因发明抗疟疾新药青蒿素和双氢青蒿素被授予诺贝尔生理学或医学奖.以异胡薄荷醇为原料是人工合成青蒿素的途径之一(如图).下列说法正确的是( )
 屠呦呦因发明抗疟疾新药青蒿素和双氢青蒿素被授予诺贝尔生理学或医学奖.以异胡薄荷醇为原料是人工合成青蒿素的途径之一(如图).下列说法正确的是( )
屠呦呦因发明抗疟疾新药青蒿素和双氢青蒿素被授予诺贝尔生理学或医学奖.以异胡薄荷醇为原料是人工合成青蒿素的途径之一(如图).下列说法正确的是( )| A. | 异胡薄荷醇遇FeCl3溶液显紫色 | |
| B. | 每个青蒿素分子中只含4个六元环 | |
| C. | 异胡薄荷醇可发生消去和加成反应 | |
| D. | 青蒿素在热的酸、碱溶液中均可稳定存在 |
8.设NA表示阿伏加德罗常数值,下列说法正确的是( )
| A. | 1L 0.1mol/L的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA | |
| B. | 标准状况下,22.4L C2H4与C3H6混合气体所含有分子数为NA | |
| C. | 相同温度下,pH=1体积为1L的硫酸溶液所含氢离子数与pH=13体积为1L的氢氧化钠溶液所含氢氧根离子数均为0.1NA | |
| D. | 18g NH42+所含的电子数11NA |
9.下列物质中既含有非极性键,又含有极性键的是( )
| A. | CO2 | B. | C2H6 | C. | NaOH | D. | H2O |