题目内容
9.下列物质中既含有非极性键,又含有极性键的是( )| A. | CO2 | B. | C2H6 | C. | NaOH | D. | H2O |
分析 同种非金属元素的原子间易形成非极性共价键;不同种非金属元素的原子间易形成极性共价键.
解答 解:A.CO2分子中只含有碳氧极性共价键,故A错误;
B.C2H6分子中碳氢极性共价键和碳碳非极性共价键,故B正确;
C.NaOH中只含有离子键和氢氧极性共价键,故C错误;
D.H2O分子中含有氧氢极性共价键,故D错误;
故选:B.
点评 本题考查化学键的极性,明确化学键判断的方法是解答本题的关键,应熟悉常见分子的构型,题目难度不大.

练习册系列答案
相关题目
19.0.1mol•L-1HIO3溶液加水稀释的图象如下,下列对该溶液叙述正确的是( )
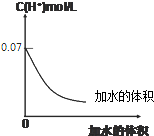

| A. | 若使溶液的pH升高1,可提高溶液的温度加水的体积 | |
| B. | 若使溶液的pH升高1,将溶液稀释到原体积的10倍 | |
| C. | 0.1 mol•L-1HIO3溶液稀释10倍后,溶液中c(H+)>c(IO3-)>c(HIO3) | |
| D. | 加水稀释过程中n(HIO3)+n((IO3-)减小 |
20.化学与社会、生活、技术和环境密切相关.下列有关说法中错误的是( )
| A. | 德美科学家因开发超分辨荧光显微镜获诺贝尔化学奖,使光学显微镜分辨率步入了纳米时代.利用此类光学显微镜可以观察活细胞内蛋白质等大分子 | |
| B. | 苹果放在空气中久置变黄和纸张久置变黄原理相似 | |
| C. | 氧化钙用作儿童食品的干燥剂存在安全隐患 | |
| D. | 绿色化学期望利用化学原理从源头消除污染,在生产过程中充分利用原料,实现零排放 |
17.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 34g质量分数为4%的H2O2水溶液中含氧原子数目为0.08NA | |
| B. | 反应3H2(g)+N2(g)?2NH3(g)△H=-92kJ/mol,若放出热量4.6kJ,则转移电子数目为0.3NA | |
| C. | 0.1mol•L-1Na2S溶液中所含S2-总数小于0.1NA | |
| D. | 6.4gCu与40mL10mol•L-1浓硝酸作用能生成NO2的分子数为0.2NA |
4.设NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 25℃时,50g 98%浓硫酸和50g 98%浓磷酸混合后含氧原子数为4NA | |
| B. | 标准状况下,活泼金属与稀硫酸反应转移2NA个电子时,可产生22.4L气体 | |
| C. | 6.4g SO2溶于水配成1L溶液,含有H2SO3的分子数为0.1NA | |
| D. | 1mol C3H6分子中碳碳共价键数为2NA |
1.二氧化碳与氢气催化合成甲醇,发生的反应为:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-46kJ•mol-1
(1)甲醇可与钠反应,写出反应的化学方程式:2CH3OH+2Na→2CH3ONa+H2↑.
(2)已知H-H、C-O、C═0、H-O键的键能依次为436kJ•mol-1、326kJ•mol-1、803kJ•mol-1、464kJ•mol-1,则C-H键的键能为414kJ•mol-1.
(3)一定条件下,将n(CO2):n(H2)=1:1的混合气充入绝热恒容密闭容器中发生反应,下列事实可以说明该反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)已达到平衡的是BCD(填字母)
A、容器内气体密度保持不变 B、CO2的体积分数保持不变
C、该反应的平衡常数保持不变 D、混合气体的平均相对分子质量不变
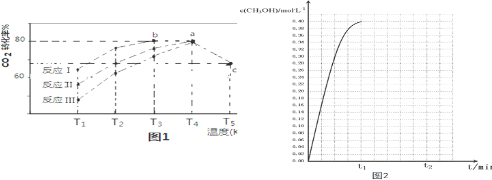
(4)一定条件下,往2L恒容密闭容器中充入1.2molCO2和3.6molH2,发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g).在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,在相同时间内CO2转化率随温度变化的数据如表所示,根据表中数据绘制如图(T5时,图中c点转化率为66.67%,即转化了$\frac{2}{3}$):
①催化剂效果最佳的反应是Ⅰ(填“Ⅰ”、“Ⅱ”、“Ⅲ”)
②T3的b点v(正)=v(逆).(填“>”“<”“=”)
③T4的a点转化率比T5的c点高原因是T4反应已经达到平衡,升高温度到T5平衡向逆反应移动,从而使CO2的转化率降低..
④在温度为T5时,该反应的平衡常数K=3.70.
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-46kJ•mol-1
(1)甲醇可与钠反应,写出反应的化学方程式:2CH3OH+2Na→2CH3ONa+H2↑.
(2)已知H-H、C-O、C═0、H-O键的键能依次为436kJ•mol-1、326kJ•mol-1、803kJ•mol-1、464kJ•mol-1,则C-H键的键能为414kJ•mol-1.
(3)一定条件下,将n(CO2):n(H2)=1:1的混合气充入绝热恒容密闭容器中发生反应,下列事实可以说明该反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)已达到平衡的是BCD(填字母)
A、容器内气体密度保持不变 B、CO2的体积分数保持不变
C、该反应的平衡常数保持不变 D、混合气体的平均相对分子质量不变
(4)一定条件下,往2L恒容密闭容器中充入1.2molCO2和3.6molH2,发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g).在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,在相同时间内CO2转化率随温度变化的数据如表所示,根据表中数据绘制如图(T5时,图中c点转化率为66.67%,即转化了$\frac{2}{3}$):
| 相同时间内CO2转化率 | T1 | T2 | T3 | T4 | T5 |
| 反应Ⅰ | 65% | 77% | 80% | 80% | 66.67% |
| 反应Ⅱ | 56% | 67% | 76% | 80% | 66.67% |
| 反应Ⅲ | 48% | 62% | 72% | 80% | 66.67% |
②T3的b点v(正)=v(逆).(填“>”“<”“=”)
③T4的a点转化率比T5的c点高原因是T4反应已经达到平衡,升高温度到T5平衡向逆反应移动,从而使CO2的转化率降低..
④在温度为T5时,该反应的平衡常数K=3.70.

5.下列物质中,属于离子化合物的是( )
| A. | N2 | B. | CO2 | C. | NaOH | D. | CH4 |
6.已知热化学方程式:2SO2(g)+O2(g)?2SO3(g)+196kJ,下列说法中正确的是( )
| A. | 在容器中充入2mol SO2(g)和2mol O2(g)充分反应,最终放出的热量为196kJ | |
| B. | 如果2molSO3(g)完全分解成SO2(g)和O2(g)时需要吸收196kJ的热量,若加入适当的催化剂后,分解所需要的热量会小于196kJ | |
| C. | 在接触法制硫酸中,通常不采用低温或者很大压强的方式来提高三氧化硫的产率 | |
| D. | 工业生产中,在吸收塔内用水吸收SO3,促进平衡的正向移动,提高了原料利用率 |