题目内容
9.下列化学用语正确的是( )| A. | 羟基的电子式  | |
| B. | F原子的轨道式 | |
| C. | 硫原子的电子排布式 1s22s22p63s23p6 | |
| D. | 氨气的结构式 |
分析 A.羟基中氧原子与氢原子形成一个共价键,中心原子O核外含有8个电子,氢原子核外2个电子;
B.F原子核外有9个电子,电子排布符合能量最低原理、保里不相容原理和洪特规则;
C.S原子的最外层76个电子,为3s22p4,为3s和3p电子,且3p轨道中应为4个电子,2个单电子.
D.氨气的结构式N原子上多2个电子.
解答 解:A.从羟基的中心原子O周围7个电子,羟基中存在一对共用电子对,羟基的电子式为 ,故A错误;
,故A错误;
B.F原子的核外有2层电子,为1s22s22p5,且2p轨道中应为1个单电子,原子的轨道式为 ,故B正确;
,故B正确;
C.硫原子质子数为16,核外3层电子,其电子排布式为 1s22s22p63s23p4,故C错误;
D.氨气为共价化合物,氨气中存在3个氮氢键,氮原子最外层达到8电子稳定结构,氨气的电子式为: ,结构式为:
,结构式为: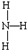 ,故D错误;
,故D错误;
故选B.
点评 本题考查了电子式、轨道式、电子排布式、结构式等知识点,题目难度中等,注意掌握常见化学用语的表示方法.

练习册系列答案
相关题目
4.某元素的微粒37X-的核外电子数为18,则该元素原子的中子数是( )
| A. | 17 | B. | 18 | C. | 19 | D. | 20 |
17.在溶液中能共存,加OH-有沉淀析出,加H+能放出气体的是( )
| A. | Na+、Cu2+、Cl-、SO42- | B. | Fe2+、K+、S2-、SO42- | ||
| C. | Na+、Ca2+、Cl-、HCO3- | D. | H+、Al3+、NH4+、CO32- |
4.在恒容密闭容器中发生反应A(g)+B(g)?C(g)+D(?)+Q,其中B为紫色,A、C、D皆为无色,D的状态不明确.下列选项中能够确定上述容器中反应已达平衡的是( )
| A. | 密度不变 | B. | 温度不变 | C. | 颜色不变 | D. | 压强不变 |
1.人类已经成功合成了117号元素Uus,关于${\;}_{117}^{294}$Uus的叙述正确的是( )
| A. | 原子内电子数多于中子数 | B. | 与${\;}_{117}^{296}$Uus电子式相同 | ||
| C. | 元素的近似相对原子质量是294 | D. | 处于不完全周期内 |
18.下列实验用酸性KMnO4溶液不能达到预期目的是( )
| A. | 鉴别SO2和CO2 | B. | 检验CH2=C(CH3)CHO中含碳碳双键 | ||
| C. | 鉴别苯和甲苯 | D. | 检验硫酸铝溶液中是否有硫酸亚铁 |
19.0.1mol•L-1HIO3溶液加水稀释的图象如下,下列对该溶液叙述正确的是( )
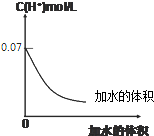

| A. | 若使溶液的pH升高1,可提高溶液的温度加水的体积 | |
| B. | 若使溶液的pH升高1,将溶液稀释到原体积的10倍 | |
| C. | 0.1 mol•L-1HIO3溶液稀释10倍后,溶液中c(H+)>c(IO3-)>c(HIO3) | |
| D. | 加水稀释过程中n(HIO3)+n((IO3-)减小 |
 用下图装置可以测定混合气体中ClO2的含量
用下图装置可以测定混合气体中ClO2的含量