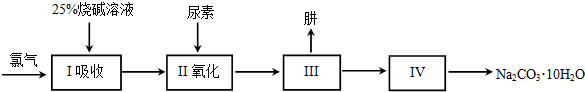
题目内容
11.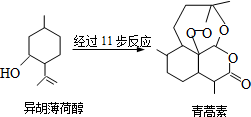 屠呦呦因发明抗疟疾新药青蒿素和双氢青蒿素被授予诺贝尔生理学或医学奖.以异胡薄荷醇为原料是人工合成青蒿素的途径之一(如图).下列说法正确的是( )
屠呦呦因发明抗疟疾新药青蒿素和双氢青蒿素被授予诺贝尔生理学或医学奖.以异胡薄荷醇为原料是人工合成青蒿素的途径之一(如图).下列说法正确的是( )| A. | 异胡薄荷醇遇FeCl3溶液显紫色 | |
| B. | 每个青蒿素分子中只含4个六元环 | |
| C. | 异胡薄荷醇可发生消去和加成反应 | |
| D. | 青蒿素在热的酸、碱溶液中均可稳定存在 |
分析 A.酚能和氯化铁溶液发生显色反应;
B.青蒿素分子中含有3个六元环;
C.异胡薄荷醇含有碳碳双键和醇羟基,具有烯烃和醇的性质;
D.青蒿素中含有酯基,能发生水解反应.
解答 解:A.酚能和氯化铁溶液发生显色反应,该物质中不含酚羟基,所以不能发生显色反应,故A错误;
B.青蒿素分子中含有3个六元环,故B错误;
C.异胡薄荷醇含有碳碳双键和醇羟基,具有烯烃和醇的性质,能发生加成反应、氧化反应、取代反应、消去反应,故C正确;
D.青蒿素中含有酯基,能发生水解反应,所以在热的酸、碱溶液中均能发生水解反应,故D错误;
故选C.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,注意常见有机物的性质分析,题目难度不大.

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
相关题目
1.人类已经成功合成了117号元素Uus,关于${\;}_{117}^{294}$Uus的叙述正确的是( )
| A. | 原子内电子数多于中子数 | B. | 与${\;}_{117}^{296}$Uus电子式相同 | ||
| C. | 元素的近似相对原子质量是294 | D. | 处于不完全周期内 |
19.0.1mol•L-1HIO3溶液加水稀释的图象如下,下列对该溶液叙述正确的是( )
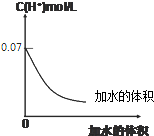

| A. | 若使溶液的pH升高1,可提高溶液的温度加水的体积 | |
| B. | 若使溶液的pH升高1,将溶液稀释到原体积的10倍 | |
| C. | 0.1 mol•L-1HIO3溶液稀释10倍后,溶液中c(H+)>c(IO3-)>c(HIO3) | |
| D. | 加水稀释过程中n(HIO3)+n((IO3-)减小 |
6.化学与生活息息相关,下列说法错误的是( )
| A. | 乙烯可作为水果的催熟剂 | |
| B. | 地沟油经过处理,可用来制造肥皂 | |
| C. | 煤炭燃烧过程安装固硫装置,可有效提高煤的利用率 | |
| D. | 发生地震后,防疫人员在震区周围撒石灰,进行环境消毒,防止灾后出现疫情 |
16.相同条件下,有关①pH=2的CH3COOH溶液;②pH=2的HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液,四种溶液的比较中,不正确的是( )
| A. | 水电离的c(H+):①=②=③=④ | |
| B. | 将②、③溶液混合后pH=7,则消耗溶液的体积:②>③ | |
| C. | 等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:②最小 | |
| D. | 向溶液中加水稀释到原来的10倍,溶液的pH:④>③>②>① |
3.下列实验方案不能达到实验目的是( )
| 选项 | 实验方案 | 实验目的 |
| A | 向酸性KMnO4溶液中滴加草酸溶液,观察紫色是否消失 | 验证草酸具有还原性 |
| B | 向相同浓度的NaBr和KI溶液中分别滴加足量氯水,观察溶液颜色变化 | 比较溴元素和碘元素的非金属性强弱 |
| C | 将铜与浓硝酸反应生成的气体收集后用冰水混合物冷却降温 | 研究温度对化学平衡的影响 |
| D | 将Mg(OH)2沉淀转入烧杯中,加足量稀硫酸溶解,加热浓缩,冷却结晶 | 制备硫酸镁晶体 |
| A. | A | B. | B | C. | C | D. | D |
20.化学与社会、生活、技术和环境密切相关.下列有关说法中错误的是( )
| A. | 德美科学家因开发超分辨荧光显微镜获诺贝尔化学奖,使光学显微镜分辨率步入了纳米时代.利用此类光学显微镜可以观察活细胞内蛋白质等大分子 | |
| B. | 苹果放在空气中久置变黄和纸张久置变黄原理相似 | |
| C. | 氧化钙用作儿童食品的干燥剂存在安全隐患 | |
| D. | 绿色化学期望利用化学原理从源头消除污染,在生产过程中充分利用原料,实现零排放 |