题目内容
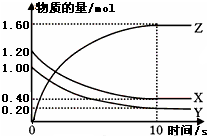 (1)某温度下,2L恒容密闭容器中,X、Y、Z三种气体发生化学反应时,物质的量随时间变化的关系曲线如图所示,则
(1)某温度下,2L恒容密闭容器中,X、Y、Z三种气体发生化学反应时,物质的量随时间变化的关系曲线如图所示,则①此反应的化学方程式为
②0~10s内,用Z表示的化学反应速率为
③X的转化率为
(2)恒温恒容时,某密闭容器中发生反应:
C(s)+CO2(g)?2CO(g),下列描述中能说明该反应已达到化学平衡状态的是
①C(s)的浓度不再改变 ②CO2的体积分数不再改变
③气体的质量不再改变 ④气体的密度不再改变
⑤单位时间内消耗1mol CO2,同时生成2mol CO
⑥n(CO2):n(CO)=1:2 ⑦v正(CO2)=2v逆(CO)
考点:物质的量或浓度随时间的变化曲线
专题:化学平衡专题
分析:(1)①根据物质的量的变化判断反应物和生成物,根据物质的量的变化之比等于化学计量数之比书写方程式;
②根据v=
计算反应速率;
③根据参加反应的物质的量与起始物质的量之比计算转化率;
(2)根据可逆反应达到平衡状态,一定满足正逆反应速率相等,各组分的浓度、百分含量不再变化,据此进行判断;
②根据v=
| △c |
| △t |
③根据参加反应的物质的量与起始物质的量之比计算转化率;
(2)根据可逆反应达到平衡状态,一定满足正逆反应速率相等,各组分的浓度、百分含量不再变化,据此进行判断;
解答:
解:(1)①由图象可以看出,反应中X、Y的物质的量减小,Z的物质的量增多,则X、Y为反应物,Z为生成物,
且△n(X):△n(Y):△n(Z)=0.8mol:0.8mol:1.6mol=1:1:2,则反应的化学方程式为:X+Y 2Z,
2Z,
故答案为:X+Y 2Z;
2Z;
②v(Z)=
=0.08mol/(L?s),故答案为:0.08mol/(L?s);
③根据图象可知参加反应的X物质的量为1.2mol-0.4mol=0.8mol,所以X的转化率为:
×100%=66.7%,故答案为:66.7%;
(2)①由于C是固体,在反应过程中浓度始终不变,所以C(s)的浓度不再改变不能作为平衡状态的判断标志;
②CO2的体积分数不再改变时,各组分的含量不再改变,反应达到 平衡状态,故可作为平衡状态的判断标志;
③在C(s)+CO2(g)?2CO(g)中,气态物质的质量是不断增大的,当气体质量不变时,说明反应已经达到 平衡状态,故可作为判断标志;
④由于该反应是在恒容条件下进行,气体质量在反应前后不守恒,即密度是不断变化的,故当密度不变是反应就达到了平衡状态;
⑤单位时间内消耗1mol CO2,同时生成2mol CO都是描述的正反应,没有说明逆反应速率,所以无法判断正逆反应速率是否相等,故无法判断反应是否处于平衡状态;
⑥n(CO2):n(CO)=1:2 时无法判断正逆反应速率是否相等,故也就无法判断反应是否处于平衡状态;
⑦反应处于平衡状态时2v正(CO2)=v逆(CO)v正,而当(CO2)=2v逆(CO)时,正反应速率是大于逆反应速率的,故反应未处于平衡状态;故答案为②③④.
且△n(X):△n(Y):△n(Z)=0.8mol:0.8mol:1.6mol=1:1:2,则反应的化学方程式为:X+Y
 2Z,
2Z,故答案为:X+Y
 2Z;
2Z;②v(Z)=
| ||
| 10s |
③根据图象可知参加反应的X物质的量为1.2mol-0.4mol=0.8mol,所以X的转化率为:
| 0.8mol |
| 1.2mol |
(2)①由于C是固体,在反应过程中浓度始终不变,所以C(s)的浓度不再改变不能作为平衡状态的判断标志;
②CO2的体积分数不再改变时,各组分的含量不再改变,反应达到 平衡状态,故可作为平衡状态的判断标志;
③在C(s)+CO2(g)?2CO(g)中,气态物质的质量是不断增大的,当气体质量不变时,说明反应已经达到 平衡状态,故可作为判断标志;
④由于该反应是在恒容条件下进行,气体质量在反应前后不守恒,即密度是不断变化的,故当密度不变是反应就达到了平衡状态;
⑤单位时间内消耗1mol CO2,同时生成2mol CO都是描述的正反应,没有说明逆反应速率,所以无法判断正逆反应速率是否相等,故无法判断反应是否处于平衡状态;
⑥n(CO2):n(CO)=1:2 时无法判断正逆反应速率是否相等,故也就无法判断反应是否处于平衡状态;
⑦反应处于平衡状态时2v正(CO2)=v逆(CO)v正,而当(CO2)=2v逆(CO)时,正反应速率是大于逆反应速率的,故反应未处于平衡状态;故答案为②③④.
点评:本题考查了根据图象写化学方程式、计算转化率、反应速率及平衡状态的判断,难度不大,解题关键在于理解化学平衡状态的特征.

练习册系列答案
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案
相关题目
NA表示阿伏伽德罗常数,下列说法正确的是( )
| A、在常温常压下,14 gN2含有的分子数为0.5NA |
| B、50 mL1 mol/L的Na2SO4溶液中含Na+数为NA |
| C、标准状况下,22.4 L H2和O2的混合气体所含分子数为NA |
| D、24 g Mg与盐酸充分反应转移电子数为NA |
液态化合物AB会发生微弱的自身电离,电离方程式为AB?A++B-,在不同温度下其平衡常数为K(25℃)=1.0×10-14,K(35℃)=2.1×10-14.则下列叙述正确的是( )
| A、AB的电离是吸热过程 |
| B、在35℃时,c(A+)>c(B-) |
| C、AB的电离程度(25℃)>(35℃) |
| D、c(A+)随温度升高而降低 |
下列操作中错误的是( )
| A、除去乙酸乙酯中的少量乙酸:加入乙醇和浓硫酸,使乙酸全部转化为乙酸乙酯 |
| B、混入Cl2中的HCl气体,可用饱和NaCl溶液除去 |
| C、除去Fe粉中的少量铝粉:加入NaOH溶液后过滤 |
| D、提取溶解在水中的少量溴:加入CCl4,振荡,静置,分层后,取出有机层再分离 |
常温常压下将氢气和氧气混合在一起,即使过上几年,它们也不会发生化合反应生成水.然而只要给一个电火花,氢气就迅速与氧气反应生成水.反应过程中的能量变化如图A所示.对比图B中的情景,漫画中的羊供给石头的“能量”相当于图A中的( )


| A、E2 |
| B、E2-E1 |
| C、E3-E2 |
| D、E3 |
常温下列各组离子在指定溶液中可能大量共存的是( )
| A、含有大量ClO-的溶液:Na+、OH-、I-、SO32- |
| B、澄清透明的溶液:Cu2+、Fe3+、NO3-、Cl- |
| C、使pH试纸变蓝的溶液:NH4+、K+、S2-、CO32- |
D、c(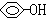 )=0.1mol/L的溶液:Na+、Cl-、CO32-、NO3- )=0.1mol/L的溶液:Na+、Cl-、CO32-、NO3- |
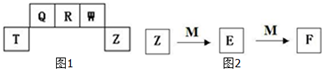 短周期元素T、Q、R、W、Z在元素周期表中的位置如图1所示,其中T所处的周期序数与主族序数相等,请用相关化学用语回答下列问题:
短周期元素T、Q、R、W、Z在元素周期表中的位置如图1所示,其中T所处的周期序数与主族序数相等,请用相关化学用语回答下列问题: