题目内容
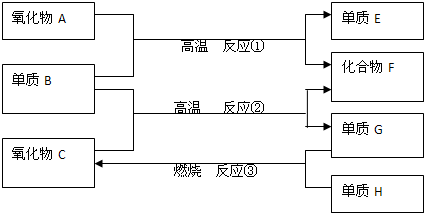
图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物.
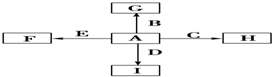
已知:①单质中只有A为金属,在大气层高空释放的蒸气呈现明亮的橙黄色云雾,科学家由此可确定火箭在空中的位置;B、C、D为气体,E为固体;C、E为有色物质.
②B与D可以生成化合物J,A与J反应生成D和另一种化合物K,C与K反应的产物含漂白液的有效成分,F、G、I的水溶液呈碱性.
回答问题:(1)化合物K的电子式为 .
(2)F的水溶液呈碱性的原因(用离子方程式表示) ,写出I与J反应的化学反应方程式 .
(3)实验室制备C的离子反应方程式为 .
(4)D在C中燃烧观察到的现象是 .
(5)可利用B与D生成化合物J的反应制成燃料电池,若1g D在B中燃烧生成气态J时,放出120.9kJ的热量,已知1mol J在汽化时吸热44.0kJ,写出表示D的燃烧热的热化学方程式 .

已知:①单质中只有A为金属,在大气层高空释放的蒸气呈现明亮的橙黄色云雾,科学家由此可确定火箭在空中的位置;B、C、D为气体,E为固体;C、E为有色物质.
②B与D可以生成化合物J,A与J反应生成D和另一种化合物K,C与K反应的产物含漂白液的有效成分,F、G、I的水溶液呈碱性.
回答问题:(1)化合物K的电子式为
(2)F的水溶液呈碱性的原因(用离子方程式表示)
(3)实验室制备C的离子反应方程式为
(4)D在C中燃烧观察到的现象是
(5)可利用B与D生成化合物J的反应制成燃料电池,若1g D在B中燃烧生成气态J时,放出120.9kJ的热量,已知1mol J在汽化时吸热44.0kJ,写出表示D的燃烧热的热化学方程式
考点:无机物的推断
专题:推断题
分析:A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物,单质中只有A为金属,在大气层高空释放的蒸气呈现明亮的橙黄色云雾,科学家由此可确定火箭在空中的位置,则A为Na;有色气体单质C与K反应的产物含漂白液的有效成分,则C为Cl2,K为NaOH,可推知H为NaCl;B与D可以生成化合物J,A(Na)与J反应生成D和另一种化合物K(NaOH),应是钠与水反应,可推知B为O2、D为H2、J为H2O,则I为NaH、G为氧化钠或过氧化钠;有色固体单质E与Na反应生成F,F的水溶液为碱性,可推知E为硫,F为Na2S,据此解答.
解答:
解:A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物,单质中只有A为金属,在大气层高空释放的蒸气呈现明亮的橙黄色云雾,科学家由此可确定火箭在空中的位置,则A为Na;有色气体单质C与K反应的产物含漂白液的有效成分,则C为Cl2,K为NaOH,可推知H为NaCl;B与D可以生成化合物J,A(Na)与J反应生成D和另一种化合物K(NaOH),应是钠与水反应,可推知B为O2、D为H2、J为H2O,则I为NaH、G为氧化钠或过氧化钠;有色固体单质E与Na反应生成F,F的水溶液为碱性,可推知E为硫,F为Na2S,
(1)化合物K为NaOH,其电子式为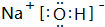 ,故答案为:
,故答案为: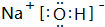 ;
;
(2)Na2S的水溶液硫离子水解:S2-+H2O?HS-+OH-,破坏水的电离平衡,溶液呈碱性;
NaH与水反应生成氢氧化钠与氢气,化学反应方程式为:NaH+H2O=NaOH+H2↑,
故答案为:S2-+H2O?HS-+OH-;NaH+H2O=NaOH+H2↑;
(3)实验室制备氯气的离子反应方程式为:MnO2+4H++2 Cl-
Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2 Cl-
Mn2++Cl2↑+2H2O;
(4)氢气在氯气中燃烧观察到的现象是:苍白色火焰,并伴有白雾生成,
故答案为:苍白色火焰,并伴有白雾生成;
(5)若1g 氢气在氧气中燃烧生成气态水时,放出120.9kJ的热量,生成1mol氢气完全燃烧生成气态水时发出的热量=120.9kJ×
=241.8kJ,1mol水在汽化时吸热44.0kJ,故1mol氢气生成液态水放出的热量=241.8kJ+44kJ=285.8kJ,则氢气燃烧热的热化学方程式为:H2(g)+
O2(g)=H2O(l)△H=-285.8kJ/mol,
故答案为:H2(g)+
O2(g)=H2O(l)△H=-285.8kJ/mol.
(1)化合物K为NaOH,其电子式为
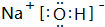 ,故答案为:
,故答案为: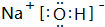 ;
;(2)Na2S的水溶液硫离子水解:S2-+H2O?HS-+OH-,破坏水的电离平衡,溶液呈碱性;
NaH与水反应生成氢氧化钠与氢气,化学反应方程式为:NaH+H2O=NaOH+H2↑,
故答案为:S2-+H2O?HS-+OH-;NaH+H2O=NaOH+H2↑;
(3)实验室制备氯气的离子反应方程式为:MnO2+4H++2 Cl-
| ||
故答案为:MnO2+4H++2 Cl-
| ||
(4)氢气在氯气中燃烧观察到的现象是:苍白色火焰,并伴有白雾生成,
故答案为:苍白色火焰,并伴有白雾生成;
(5)若1g 氢气在氧气中燃烧生成气态水时,放出120.9kJ的热量,生成1mol氢气完全燃烧生成气态水时发出的热量=120.9kJ×
| 1mol×2g/mol |
| 1g |
| 1 |
| 2 |
故答案为:H2(g)+
| 1 |
| 2 |
点评:本题考查无机物推断,金属A的焰色反应为推断突破口,需要学生熟练掌握元素化合物性质,(5)中关键是计算反应热,为易错点,学生容易忽略书写燃烧热的热化学方程式,难度中等.

练习册系列答案
相关题目
有Xn-、Yn+、Z(n+1)-三种粒子,其核外电子层结构相同,则下列分析中不正确的是( )
| A、原子核电荷数:Y>X>Z |
| B、原子半径大小的关系是:Y>Z>X |
| C、离子半径大小的关系是:Z(n+1)->Xn->Yn+ |
| D、氢化物的稳定性:Hn+1Z>HnX |
有以下描述的事实:
①氯化铁溶液加热蒸干最终得不到氯化铁固体;
②铁在潮湿的空气中容易生锈;
③实验室可用排饱和食盐水的方法收集氯气;
④在可逆反应中,使用催化剂有利于提高反应物的转化率;
⑤常温下,将1mol pH=3的醋酸溶液加水稀释至100ml,测得其pH<5
⑥二氧化氮与四氧化氮的平衡体系,加压后颜色加深.
其中能用勒夏特列原理解释的是( )
①氯化铁溶液加热蒸干最终得不到氯化铁固体;
②铁在潮湿的空气中容易生锈;
③实验室可用排饱和食盐水的方法收集氯气;
④在可逆反应中,使用催化剂有利于提高反应物的转化率;
⑤常温下,将1mol pH=3的醋酸溶液加水稀释至100ml,测得其pH<5
⑥二氧化氮与四氧化氮的平衡体系,加压后颜色加深.
其中能用勒夏特列原理解释的是( )
| A、①②③ | B、④⑤⑥ |
| C、①③⑤ | D、①③④⑤ |
NA表示阿伏伽德罗常数,下列说法正确的是( )
| A、在常温常压下,14 gN2含有的分子数为0.5NA |
| B、50 mL1 mol/L的Na2SO4溶液中含Na+数为NA |
| C、标准状况下,22.4 L H2和O2的混合气体所含分子数为NA |
| D、24 g Mg与盐酸充分反应转移电子数为NA |
下列操作中错误的是( )
| A、除去乙酸乙酯中的少量乙酸:加入乙醇和浓硫酸,使乙酸全部转化为乙酸乙酯 |
| B、混入Cl2中的HCl气体,可用饱和NaCl溶液除去 |
| C、除去Fe粉中的少量铝粉:加入NaOH溶液后过滤 |
| D、提取溶解在水中的少量溴:加入CCl4,振荡,静置,分层后,取出有机层再分离 |
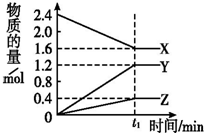 某温度下,在2L密闭容器中3种气态物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.反应在t1 min时到达平衡,如图所示:
某温度下,在2L密闭容器中3种气态物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.反应在t1 min时到达平衡,如图所示: 某温度下,在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.反应在t1min时到达平衡,依图所示:
某温度下,在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.反应在t1min时到达平衡,依图所示: