题目内容
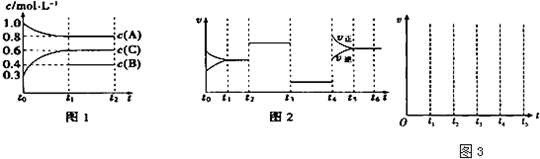
 某温度时,在一个容积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
某温度时,在一个容积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:(1)该反应在
(2)该反应的化学方程式为
(3)反应开始至2min,气体Z的反应速率为
(4)若X、Y、Z均为气体,反应达到平衡时压强是开始时的
考点:物质的量或浓度随时间的变化曲线
专题:化学平衡专题
分析:(1)根据图象中曲线变化判断化学平衡状态;
(2)根据物质的量变化曲线,可知X、Y物质的量减小,为反应物;反应物没有完全反应,所以该反应为可逆反应;Z物质的量增加,为生成物,再根据其物质的量变化量之比等于其计量数之比,可写出化学方程式;
(3)根据2min内Z物质的量变化量和容器体积,可知道浓度变化量,通过计算可知用气体Z表示的反应速率;
(4)①气体的压强之比等于气体的物质的量之比,可求出开始时气体的总物质的量和平衡后气体总物质的量,得到答案;
(2)根据物质的量变化曲线,可知X、Y物质的量减小,为反应物;反应物没有完全反应,所以该反应为可逆反应;Z物质的量增加,为生成物,再根据其物质的量变化量之比等于其计量数之比,可写出化学方程式;
(3)根据2min内Z物质的量变化量和容器体积,可知道浓度变化量,通过计算可知用气体Z表示的反应速率;
(4)①气体的压强之比等于气体的物质的量之比,可求出开始时气体的总物质的量和平衡后气体总物质的量,得到答案;
解答:
解:(1)图象中曲线在2min时,浓度不再发生变化,达到化学平衡状态,故答案为:2;
(2)△n(X)=0.3mol;△n(Y)=0.1mol;△n(Z)=0.2mol,所以三者计量数之比为3:1:2,故答案为:3X+Y?2Z;
(3)vv(Z)=
=
═0.05mol?L-1?min-1,故答案为:0.05mol?L-1?min-1;
(4)根据图象中可知,开始时气体总物质的量为:2mol;平衡后气体总物质的量为:0.9mol+0.7mol+0.2mol=1.8mol,
=
=
═0.9,
故答案为:0.9.
(2)△n(X)=0.3mol;△n(Y)=0.1mol;△n(Z)=0.2mol,所以三者计量数之比为3:1:2,故答案为:3X+Y?2Z;
(3)vv(Z)=
| △c |
| △t |
| 0.2mol |
| 2L?2min |
(4)根据图象中可知,开始时气体总物质的量为:2mol;平衡后气体总物质的量为:0.9mol+0.7mol+0.2mol=1.8mol,
| P平衡 |
| P起始 |
| n平衡 |
| n起始 |
| 1.8mol |
| 2mol |
故答案为:0.9.
点评:该题通过图象中物质的物质的量的变化,来考查化学平衡的移动、化学反应速率计算,还涉及到阿伏伽德罗定律,综合考查学生对知识的综合应用能力.

练习册系列答案
相关题目
有以下描述的事实:
①氯化铁溶液加热蒸干最终得不到氯化铁固体;
②铁在潮湿的空气中容易生锈;
③实验室可用排饱和食盐水的方法收集氯气;
④在可逆反应中,使用催化剂有利于提高反应物的转化率;
⑤常温下,将1mol pH=3的醋酸溶液加水稀释至100ml,测得其pH<5
⑥二氧化氮与四氧化氮的平衡体系,加压后颜色加深.
其中能用勒夏特列原理解释的是( )
①氯化铁溶液加热蒸干最终得不到氯化铁固体;
②铁在潮湿的空气中容易生锈;
③实验室可用排饱和食盐水的方法收集氯气;
④在可逆反应中,使用催化剂有利于提高反应物的转化率;
⑤常温下,将1mol pH=3的醋酸溶液加水稀释至100ml,测得其pH<5
⑥二氧化氮与四氧化氮的平衡体系,加压后颜色加深.
其中能用勒夏特列原理解释的是( )
| A、①②③ | B、④⑤⑥ |
| C、①③⑤ | D、①③④⑤ |
下列操作中错误的是( )
| A、除去乙酸乙酯中的少量乙酸:加入乙醇和浓硫酸,使乙酸全部转化为乙酸乙酯 |
| B、混入Cl2中的HCl气体,可用饱和NaCl溶液除去 |
| C、除去Fe粉中的少量铝粉:加入NaOH溶液后过滤 |
| D、提取溶解在水中的少量溴:加入CCl4,振荡,静置,分层后,取出有机层再分离 |
60 27 |
60 27 |
| A、是一种核素 | ||
| B、质子数是60 | ||
C、与
| ||
| D、中子数是33 |
 某温度下,在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.反应在t1min时到达平衡,依图所示:
某温度下,在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.反应在t1min时到达平衡,依图所示: I.Fe2+和I-是两种常见的还原性离子.
I.Fe2+和I-是两种常见的还原性离子.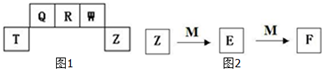 短周期元素T、Q、R、W、Z在元素周期表中的位置如图1所示,其中T所处的周期序数与主族序数相等,请用相关化学用语回答下列问题:
短周期元素T、Q、R、W、Z在元素周期表中的位置如图1所示,其中T所处的周期序数与主族序数相等,请用相关化学用语回答下列问题: