题目内容
10.铁及其化合物在生产和生活中有广泛的应用.Ⅰ、高铁酸钠(Na2FeO4)是一种新型净水剂,工业上制备高铁酸钠的反应原理为:
Fe(OH)3+NaClO+NaOH→Na2FeO4+X+H2O(未配平),则X的电子式为
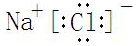 ,反应中被氧化的物质是Fe(OH)3(写化学式).
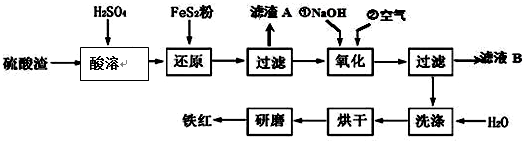
,反应中被氧化的物质是Fe(OH)3(写化学式).Ⅱ、铁红颜料跟某些油料混合,可以制成防锈油漆.工业制硫酸产生的硫酸渣中主要含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如图:
已知:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
(1)酸溶过程中Fe2O3与稀硫酸反应的化学方程式为Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;“滤渣A”主要成份的化学式为SiO2.
(2)还原过程中加入FeS2的目的是将溶液中的Fe3+还原为Fe2+,而本身被氧化为H2SO4,写出该反应的离子方程式FeS2+14Fe3++8H2O═15Fe2++2SO42-+16H+.
(3)为确保铁红的质量和纯度,氧化过程中加NaOH调节溶液pH的范围是3.2~3.8;如果加NaOH调节溶液pH=a,则滤液B中c(Fe3+)=4×10(4-3a)mol/L(25℃时,Ksp=4×10-38)
(4)以甲醚、空气、氢氧化钾溶液为原料,石墨为电极可以构成燃料电池.该电池负极的电极反应式为CH3OCH3+16OH--12e-=2CO32-+11H2O.
分析 Ⅰ、氧化还原反应元素化合价升降分析配平化学方程式,根据质量守恒定律的实质,反应前后各元素的原子个数相等推断X的化学式,再写出X的电子式,元素化合价升高失电子被氧化;
Ⅱ、硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,稀硫酸溶解主要除去不与酸反应的SiO2,加入FeS2将溶液中的Fe3+还原为Fe2+,再加氢氧化钠和空气,调节溶液的pH的范围是3.2~3.8主要是使三价铁沉淀,而二价镁,三价铝都不沉淀,最后洗涤、烘干、研磨使氢氧化铁分解生成氧化铁,从而得到铁红;
(1)氧化铁属于碱性氧化物,与酸反应生成盐和水;Fe2O3、Al2O3、MgO都和硫酸反应,二氧化硅不和酸反应;
(2)根据得失电子守恒和原子守恒来配平,FeS2中S元素的化合价从-1价升高到+6价,2个S原子转移14个电子,Fe3+转移1个电子,则二者的计量数之比为1:14,根据S守恒可知SO42-前面的化学计量数为2,根据氧守恒可知H20前面化学计量数为8,根据H守恒可知H+前化学计量数为16;
(3)根据几种离子沉淀的pH,应选择使Fe3+沉淀完全而其他离子不沉淀,结合溶度积常数计算分析;
(4)燃料电池通氧气的极为正极,负极发生氧化反应,书写电极反应式时要考虑电解质溶液对电极反应的影响.
解答 解:Ⅰ、根据元素化合价变化配平书写化学方程式,铁元素化合价+3价变化为+6价,氯元素化合价+1价应变化为-1价,2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3X+5H2O可知,反应前铁、氧、氢、钠、氯的原子个数分别是:2、13、10、7、3,反应后铁、氧、氢、钠、氯的原子个数分别是:2、13、10、4、0,所以每个X中含有1个钠离子和1个氯离子,X是氯化钠,其电子式为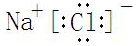 ,氢氧化铁中铁元素化合价升高被氧化,
,氢氧化铁中铁元素化合价升高被氧化,
故答案为: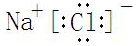 ,Fe(OH)3;
,Fe(OH)3;
Ⅱ、硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,稀硫酸溶解主要除去不与酸反应的SiO2,加入FeS2将溶液中的Fe3+还原为Fe2+,再加氢氧化钠和空气,调节溶液的pH的范围是3.2~3.8主要是使三价铁沉淀,而二价镁,三价铝都不沉淀,最后洗涤、烘干、研磨使氢氧化铁分解生成氧化铁,从而得到铁红;
(1)氧化铁与硫酸反应生成硫酸铁和水,方程式为:Fe2O3+3H2SO4═Fe2(SO4) 3+3H2O;因二氧化硅不与硫酸反应,故“滤渣A”主要成份的化学式为SiO2.
故答案为:Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;SiO2;
(2)FeS2中S元素的化合价从-1价升高到+6价,2个S原子转移14个电子,Fe3+转移1个电子,则二者的计量数之比为1:14,根据S守恒可知SO42-前面的化学计量数为2,根据氧守恒可知H20前面化学计量数为8,根据H守恒可知H+前化学计量数为16,则反应的离子方程式为:FeS2+14Fe3++8H2O═15Fe2++2SO42-+16H+,
故答案为:FeS2+14Fe3++8H2O═15Fe2++2SO42-+16H+;
(3)根据几种离子沉淀的pH,使Fe3+沉淀完全的PH为3.2,其他离子开始沉淀PH为3.8,因此所选PH因介于3.2和3.8之间,如果加NaOH调节溶液的pH=a,c(OH-)=$\frac{{10}^{-14}}{{10}^{-a}}$,25℃时,Ksp[Fe(OH)3]=4×10-38 ,则滤液B中的c(Fe3+)=$\frac{{K}_{sp}}{{c}^{3}(O{H}^{-})}$=$\frac{{4×10}^{-38}}{(\frac{{10}^{-14}}{{10}^{-a}})^{3}}$=4×10(4-3a),
故答案为:3.2~3.8,4×10(4-3a);
(4)以甲醚、空气、氢氧化钾溶液为原料,石墨为电极可以构成燃料电池,负极上甲醚发生氧化反应,在氢氧化钾溶液为电解液时氧化产物为K2CO3,则负极电极反应式为CH3OCH3+16OH--12e-=2CO32-+11H2O,故答案为:CH3OCH3+16OH--12e-=2CO32-+11H2O.
点评 本题通过制备铁红,考查了物质制备方案的设计及化学实验基本操作方法的综合应用、燃料电池的电化学原理,题目难度中等,明确制备流程及化学实验基本操作方法为解答关键,试题充分考查了学生的分析、理解能力及化学实验能力.

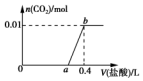 向NaOH和Na2CO3混合溶液中滴加0.1mol•L-1稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示.下列判断正确的是 ( )
向NaOH和Na2CO3混合溶液中滴加0.1mol•L-1稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示.下列判断正确的是 ( )| A. | 在0~a范围内,只发生NaOH和HCl的反应 | |
| B. | ab段发生反应的离子方程式为:CO32-+2H+═CO2↑+H2O | |
| C. | a=0.3 | |
| D. | 原混合溶液中NaOH与Na2CO3的物质的量之比为1:2 |
①“PM2.5”是细小颗粒物悬浮在空气中形成胶体,严重危害人体健康
②纯碱既属于正盐又属于钠盐和碳酸盐
③相同温度下,氢氧化钠溶液的导电能力与氨水溶液强
④丁达尔效应可用于区别溶液和胶体,烟、云、雾均为胶体,能产生丁达尔效应.
⑤钢铁的吸氧腐蚀,负极发生反应:Fe-2e-═Fe2+.
| A. | ①②④⑤ | B. | ②③④ | C. | ②④⑤ | D. | ③④⑤ |
| A. | 植物油久置会出现油脂的酸败现象,是因为油脂发生了水解 | |
| B. | 有机玻璃、合成橡胶、涤纶都是由加聚反应制得的 | |
| C. | 糖类、油脂、蛋白质的水解产物都是非电解质 | |
| D. | 将已成熟的水果放入未成熟的水果中并密封,可加速水果成熟 |
| 元素代号 | 元素的性质或原子结构 |
| W | M层上的电子数为4 |
| X | 常温下,其单质为双原子分子,其氢化物的水溶液显碱性 |
| Y | L层电子数为次外层电子数的3倍 |
| Z | 元素最高正价是+7价 |
| A. | 原子半径:W>X>Y | |
| B. | 化合物WY2不溶于水 | |
| C. | 由X、Y和氢三种元素形成的所有化合物中只含共价键 | |
| D. | 最高价氧化物对应水化物的酸性:W<Z |
(2)如图2所示,每条折线表示周期表ⅣA-ⅦA中的某一族元素氢化物的沸点变化.每个小黑点代表一种氢化物,其中a点代表的是SiH4.
(3)化合物(CH3)3N与盐酸反应生成【(CH3)3 NH】+,该过程新生成的化学键为b.(填序号)
a.离子键 b.配位键 c.氢键 d.非极性共价键
若化合物(CH3)3N能溶于水,试解析其原因化合物(CH3)3N为极性分子且可与水分子间形成氢键
(4)CO2在高温高压下所形成的晶体其晶胞如图3所示.该晶体的熔点比SiO2晶体高(选填“高”或“低”),该晶体中碳原子轨道的杂化类型为sp3.
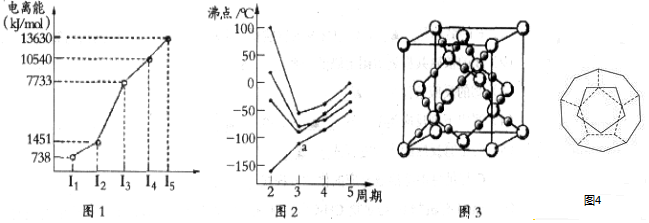
(5)如图4为20个碳原子组成的空心笼状分子C20,该笼状结构是由许多正五边形构成如图.C20分子中每个碳原子只跟相邻的3个碳原子形成化学键;
则:C20分子共有12个正五边形,共有30条棱边.
(6)Cu2+等过渡元素水合离子是否有颜色与原子结构有关,且存在一定的规律.试推断Ni2+的水合离子为有(填“有”或“无”)色离子,依据是Ni2+的3d轨道上有未成对电子.
| 离子 | Sc3+ | Ti3+ | Fe2+ | Cu2+ | Zn2+ |
| 颜色 | 无色 | 紫红色 | 浅绿色 | 蓝色 | 无色 |
| A. | 人类目前所直接利用的能量全部是由化学反应产生的 | |
| B. | 化学反应不一定伴随着能量变化 | |
| C. | 化学变化中的能量变化主要是由化学键变化引起的 | |
| D. | 化学反应中能量变化的大小与反应物质量的多少无关 |
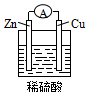
| A. | 铜片是负极 | B. | 氢离子在铜片表面被还原 | ||
| C. | 电流从锌片经导线流向铜片 | D. | 铜片质量逐渐减少 |
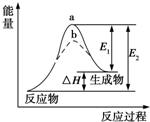
| A. | 该反应的反应热△H=E2-E1 | |
| B. | 催化剂能改变反应的焓变 | |
| C. | 催化剂能降低反应的活化能 | |
| D. | a、b分别对应无催化剂和有催化剂的能量变化 |