题目内容
16.某化学反应的能量变化如图所示.下列有关叙述不正确的是( )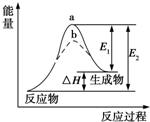
| A. | 该反应的反应热△H=E2-E1 | |
| B. | 催化剂能改变反应的焓变 | |
| C. | 催化剂能降低反应的活化能 | |
| D. | a、b分别对应无催化剂和有催化剂的能量变化 |
分析 由图可知反应物总能量小于生成物总能量,为吸热反应,且△H=E2-E1,加入催化剂,可降低 反应的活化能,但反应热不变,以此解答该题.
解答 解:A.反应为吸热反应,焓变为生成物、反应物的总能量之差,△H=E2-E1,故A正确;
B.焓变与反应物、生成物的总能量有关,加入催化剂不会改变化学反应的焓变,故B错误;
C.催化剂能降低反应的活化能,从而加快化学反应速率,故C正确;
D.催化剂会降低反应的活化能,a、b分别对应无催化剂和有催化剂的能量变化,故D正确.
故选B.
点评 本题考查了反应能量变化的分析判断,为高频考点,侧重考查学生的分析能力,图象分析是解题关键,反应的能量守恒是判断的依据,注意加入催化剂不会改变化学平衡,会降低反应的活化能,题目较简单.

练习册系列答案
相关题目
10.铁及其化合物在生产和生活中有广泛的应用.
Ⅰ、高铁酸钠(Na2FeO4)是一种新型净水剂,工业上制备高铁酸钠的反应原理为:
Fe(OH)3+NaClO+NaOH→Na2FeO4+X+H2O(未配平),则X的电子式为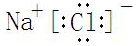 ,反应中被氧化的物质是Fe(OH)3(写化学式).
,反应中被氧化的物质是Fe(OH)3(写化学式).
Ⅱ、铁红颜料跟某些油料混合,可以制成防锈油漆.工业制硫酸产生的硫酸渣中主要含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如图:
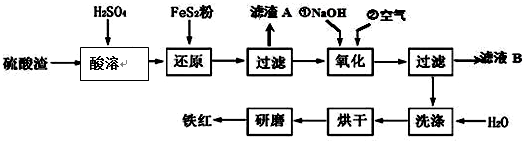
已知:
已知FeS2是一种黄色难溶于水的固体.
(1)酸溶过程中Fe2O3与稀硫酸反应的化学方程式为Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;“滤渣A”主要成份的化学式为SiO2.
(2)还原过程中加入FeS2的目的是将溶液中的Fe3+还原为Fe2+,而本身被氧化为H2SO4,写出该反应的离子方程式FeS2+14Fe3++8H2O═15Fe2++2SO42-+16H+.
(3)为确保铁红的质量和纯度,氧化过程中加NaOH调节溶液pH的范围是3.2~3.8;如果加NaOH调节溶液pH=a,则滤液B中c(Fe3+)=4×10(4-3a)mol/L(25℃时,Ksp=4×10-38)
(4)以甲醚、空气、氢氧化钾溶液为原料,石墨为电极可以构成燃料电池.该电池负极的电极反应式为CH3OCH3+16OH--12e-=2CO32-+11H2O.
Ⅰ、高铁酸钠(Na2FeO4)是一种新型净水剂,工业上制备高铁酸钠的反应原理为:
Fe(OH)3+NaClO+NaOH→Na2FeO4+X+H2O(未配平),则X的电子式为
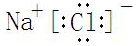 ,反应中被氧化的物质是Fe(OH)3(写化学式).
,反应中被氧化的物质是Fe(OH)3(写化学式).Ⅱ、铁红颜料跟某些油料混合,可以制成防锈油漆.工业制硫酸产生的硫酸渣中主要含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如图:

已知:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
(1)酸溶过程中Fe2O3与稀硫酸反应的化学方程式为Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;“滤渣A”主要成份的化学式为SiO2.
(2)还原过程中加入FeS2的目的是将溶液中的Fe3+还原为Fe2+,而本身被氧化为H2SO4,写出该反应的离子方程式FeS2+14Fe3++8H2O═15Fe2++2SO42-+16H+.
(3)为确保铁红的质量和纯度,氧化过程中加NaOH调节溶液pH的范围是3.2~3.8;如果加NaOH调节溶液pH=a,则滤液B中c(Fe3+)=4×10(4-3a)mol/L(25℃时,Ksp=4×10-38)
(4)以甲醚、空气、氢氧化钾溶液为原料,石墨为电极可以构成燃料电池.该电池负极的电极反应式为CH3OCH3+16OH--12e-=2CO32-+11H2O.
4.下列说法正确的是( )
| A. | 电子云中的每个小黑点代表一个电子 | |
| B. | σ键采用“肩并肩”的重叠方式 | |
| C. | 含有配位键的化合物就叫配合物 | |
| D. | 血红素、叶绿素、维生素B12都是配合物 |
11.下列实验操作与预期目的或所得结论一致的是( )
| 选项 | 实验操作 | 实验目的或结论 |
| A | 向某盐溶液中加入AgNO3溶液,产生白色沉淀;加入浓NaOH溶液加热,生成使湿润红色石蕊试纸变蓝的气体 | 该盐一定是NH4Cl |
| B | 向浓硝酸中加入足量铜片充分反应,所得气体显红棕色 | 该气体是纯净的NO2 |
| C | 常温下,向浓度均为0.01mol/L的Na2CO3和Na2SO4的混合溶液中滴加1~2滴BaCl2溶液,滤出的沉淀不溶于盐酸 | 说明常温下Ksp(BaCO3)>Ksp(BaSO4) |
| D | 向Na2O2与水反应后所得溶液中加少量MnO2 | 检验Na2O2与水反应的中 间产物为H2O2 |
| A. | A | B. | B | C. | C | D. | D |
1.有关化学实验的下列操作中,一般情况下不能相互接触的是( )
| A. | 过滤操作中,玻璃棒与三层滤纸 | |
| B. | 过滤操作中,漏斗下端与烧杯内壁 | |
| C. | 加热试管内物质时,试管底部与酒精灯灯芯不接触 | |
| D. | 用胶头滴管向试管中滴加液体时,滴管尖端与试管内壁 |
5.下列氧化还原反应中,水作为氧化剂的是( )
| A. | 2F2+2H2O═4HF+O2 | B. | Cl2+H2O═HClO+HCl | ||
| C. | 2Na2O2+2H2O═4NaOH+O2↑ | D. | CO+H2O$\frac{\underline{\;高温\;}}{\;}$CO2+H2 |
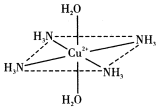 往硫酸铜水溶液中加入氨水,首先生成难溶物,继续加氨水,难溶物溶解,而且所得溶液的颜色比原来明显加深,得到了一种含2+的溶液,此离子的立体结构如图所示(4个NH3与Cu2+共面,跟H2O-Cu2+-H2O轴线垂直).请回答以下问题:
往硫酸铜水溶液中加入氨水,首先生成难溶物,继续加氨水,难溶物溶解,而且所得溶液的颜色比原来明显加深,得到了一种含2+的溶液,此离子的立体结构如图所示(4个NH3与Cu2+共面,跟H2O-Cu2+-H2O轴线垂直).请回答以下问题: