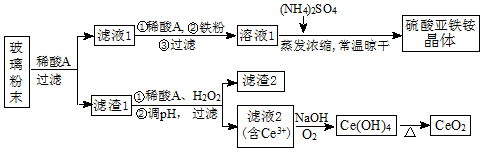
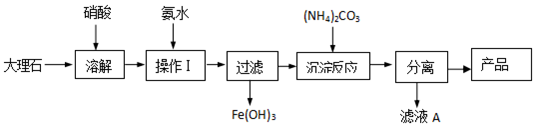
题目内容
15.(1)第四周期的某主族元素,其第一至五电离能数据如图1所示,则该元素对应原子的M层电子排布式为3s23p6.(2)如图2所示,每条折线表示周期表ⅣA-ⅦA中的某一族元素氢化物的沸点变化.每个小黑点代表一种氢化物,其中a点代表的是SiH4.
(3)化合物(CH3)3N与盐酸反应生成【(CH3)3 NH】+,该过程新生成的化学键为b.(填序号)
a.离子键 b.配位键 c.氢键 d.非极性共价键
若化合物(CH3)3N能溶于水,试解析其原因化合物(CH3)3N为极性分子且可与水分子间形成氢键
(4)CO2在高温高压下所形成的晶体其晶胞如图3所示.该晶体的熔点比SiO2晶体高(选填“高”或“低”),该晶体中碳原子轨道的杂化类型为sp3.
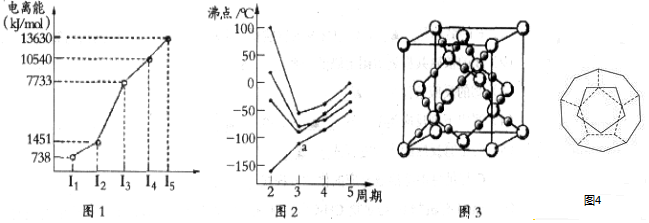
(5)如图4为20个碳原子组成的空心笼状分子C20,该笼状结构是由许多正五边形构成如图.C20分子中每个碳原子只跟相邻的3个碳原子形成化学键;
则:C20分子共有12个正五边形,共有30条棱边.
(6)Cu2+等过渡元素水合离子是否有颜色与原子结构有关,且存在一定的规律.试推断Ni2+的水合离子为有(填“有”或“无”)色离子,依据是Ni2+的3d轨道上有未成对电子.
| 离子 | Sc3+ | Ti3+ | Fe2+ | Cu2+ | Zn2+ |
| 颜色 | 无色 | 紫红色 | 浅绿色 | 蓝色 | 无色 |
分析 (1)根据该元素的第一至五电离能数据可知,该元素第一二电离能较小,说明容易失去2个电子,即最外层有两个电子,则为第IIA族元素Ca,据此分析;
(2)根据相对分子质量与物质熔沸点的关系以及氢键的存在对物质性质的影响判断;
(3)化合物(CH3)3N与盐酸反应生成[(CH3)3 NH]+,该过程新生成的化学键为氮与质子氢离子形成配位键;极性分子(CH3)3N和水之间形成氢键,所以溶解性增强;
(4)根据构成晶体的微粒及微粒间的作用力判断,根据C原子形成的价层电子对数判断;
(5)根据图片知,每个顶点上有1个碳原子,所以顶点个数等于碳原子个数为20,每个顶点含有棱边数=$\frac{1}{2}$×3=1.5,每个面含有顶点个数=$\frac{1}{3}×5$=$\frac{5}{3}$,利用均摊法或根据欧拉定理计算;
(6)Cu原子的核外电子排布式为1s22s22p63s23p63d104s1,故Cu2+的外围电子排布式为3d9,Zn2+离子的原子核外排布式为1s22s22p63s23p63d10,d轨道上有10个电子,故Zn2+ 无色,Sc3+离子的原子核外排布式为1s22s22p63s23p6,其d轨道上有0电子,处于全空,故没有颜色,Ni2+离子的原子核外排布式为1s22s22p63s23p63d8,3d轨道上有未成对电子,所以有色离子;
(7)FexO晶体的晶胞结构为NaCl型,所以每个晶胞中含有4个O原子,有4个“FexO”,再根据m=ρV计算.
解答 解:(1)由该元素的第一至五电离能数据可知,该元素第一二电离能较小,说明容易失去2个电子,即最外层有两个电子,已知该元素为第四周期的某主族元素,
则为第四周期,第IIA族元素Ca,其电子排布为2、8、8、2,所以M层有8个电子,则M层电子排布式为:3s23p6;
故答案为:3s23p6;
(2)在ⅣA~ⅦA中的氢化物里,NH3、H2O、HF因存在氢键,故沸点高于同主族相邻元素氢化物的沸点,只有ⅣA族元素氢化物不存在反常现象,组成与结构相似,相对分子量越大,分子间作用力越大,沸点越高,故a点代表的应是第IVA族的第二种元素Si的氢化物,即SiH4,
故答案为:SiH4;
(3)化合物(CH3)3N与盐酸反应生成[(CH3)3 NH]+,该过程新生成的化学键为氮与质子氢离子形成配位键,所以选b,极性分子(CH3)3N和水之间形成氢键,所以溶解性增强,
故答案为:b;化合物(CH3)3N为极性分子且可与水分子间形成氢键;
(4)CO2在高温高压下所形成的晶体其晶胞如图所示.该晶体中原子之间通过共价键结合,属于原子晶体,而碳氧键的键长短,所以该晶体的熔点比SiO2晶体高;该晶体中C原子形成4个C-O单键,则C原子含有4价层电子对,所以C原子轨道的杂化类型为sp3,
故答案为:高;sp3;
(5)根据图片知,每个顶点上有1个碳原子,所以顶点个数等于碳原子个数为20,每个顶点含有棱边数=$\frac{1}{2}$×3=1.5,每个面含有顶点个数=$\frac{1}{3}×5$=$\frac{5}{3}$,则面数=$\frac{\frac{20}{5}}{3}$=12,
或根据欧拉定理得面数=2+棱边数-顶点数=2+30-20=12,
故答案为:12;30;
(6)Cu原子的核外电子排布式为1s22s22p63s23p63d104s1,故Cu2+的外围电子排布式为3d9,Zn2+离子的原子核外排布式为1s22s22p63s23p63d10,d轨道上有10个电子,故Zn2+ 无色,Sc3+离子的原子核外排布式为1s22s22p63s23p6,其d轨道上有0电子,处于全空,故没有颜色,Ni2+离子的原子核外排布式为1s22s22p63s23p63d8,3d轨道上有未成对电子,所以有色离子,故答案为:有;Ni2+的3d轨道上有未成对电子;
(7)FexO晶体的晶胞结构为NaCl型,所以每个晶胞中含有4个O原子,有4个“FexO”,再根据m=ρV可知:4×$\frac{56x+16}{{N}_{A}}$g=5.71g•cm-3×(4.28×10-8 cm)3,解得:x=0.92,故答案为:0.92.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、空间构型与杂化方式判断、晶胞结构与计算,(7)中计算为易错点、难点,注意识记中学常见晶胞结构,难度中等.

 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案 |  |
| A.向100mL 0.1mol•L-1H2SO4溶液中滴加 0.1mol•L-1Ba(OH)2溶液至过量 | B.向100mL 0.1mol•L-1H2SO4溶液中加入NaOH固体 |
 |  |
| C.向一定浓度的氯化钠溶液中加水 | D.向蒸馏水中通入HCl气体 |
| A. | A | B. | B | C. | C | D. | D |
( )
| A. | 若混合后溶液中c(H+)>c(OH-),则一定有V1<V2 | |
| B. | 若V1=V2,则二者混合后的溶液中pH>7 | |
| C. | 混合溶液中可能存在:c ( F-)>c (H+)>c (Na+)>c( OH-) | |
| D. | 二者恰好反应完时,则所得溶液中c(F-)=c (Na+) |
Ⅰ、高铁酸钠(Na2FeO4)是一种新型净水剂,工业上制备高铁酸钠的反应原理为:
Fe(OH)3+NaClO+NaOH→Na2FeO4+X+H2O(未配平),则X的电子式为
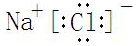 ,反应中被氧化的物质是Fe(OH)3(写化学式).
,反应中被氧化的物质是Fe(OH)3(写化学式).Ⅱ、铁红颜料跟某些油料混合,可以制成防锈油漆.工业制硫酸产生的硫酸渣中主要含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如图:
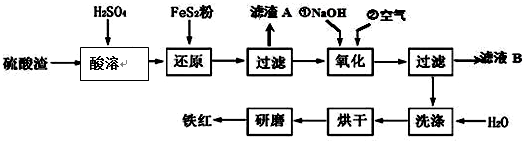
已知:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
(1)酸溶过程中Fe2O3与稀硫酸反应的化学方程式为Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;“滤渣A”主要成份的化学式为SiO2.
(2)还原过程中加入FeS2的目的是将溶液中的Fe3+还原为Fe2+,而本身被氧化为H2SO4,写出该反应的离子方程式FeS2+14Fe3++8H2O═15Fe2++2SO42-+16H+.
(3)为确保铁红的质量和纯度,氧化过程中加NaOH调节溶液pH的范围是3.2~3.8;如果加NaOH调节溶液pH=a,则滤液B中c(Fe3+)=4×10(4-3a)mol/L(25℃时,Ksp=4×10-38)
(4)以甲醚、空气、氢氧化钾溶液为原料,石墨为电极可以构成燃料电池.该电池负极的电极反应式为CH3OCH3+16OH--12e-=2CO32-+11H2O.
| A. | 铝片与稀盐酸反应 | B. | 灼热的炭与水蒸气的反应 | ||
| C. | Ba(OH)2•8H2O与NH4Cl反应 | D. | 甲烷在氧气中的燃烧反应 |
| A. | 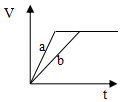 | B. | 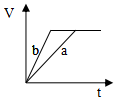 | C. | 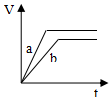 | D. | 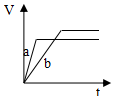 |
| A. | 过滤操作中,玻璃棒与三层滤纸 | |
| B. | 过滤操作中,漏斗下端与烧杯内壁 | |
| C. | 加热试管内物质时,试管底部与酒精灯灯芯不接触 | |
| D. | 用胶头滴管向试管中滴加液体时,滴管尖端与试管内壁 |