题目内容
20.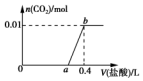 向NaOH和Na2CO3混合溶液中滴加0.1mol•L-1稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示.下列判断正确的是 ( )
向NaOH和Na2CO3混合溶液中滴加0.1mol•L-1稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示.下列判断正确的是 ( )| A. | 在0~a范围内,只发生NaOH和HCl的反应 | |
| B. | ab段发生反应的离子方程式为:CO32-+2H+═CO2↑+H2O | |
| C. | a=0.3 | |
| D. | 原混合溶液中NaOH与Na2CO3的物质的量之比为1:2 |
分析 对NaOH和Na2CO3混合配成的溶液,当滴加盐酸时,先发生氢氧化钠与盐酸的中和反应,再发生碳酸钠与盐酸的反应生成碳酸氢钠和氯化钠,最后发生碳酸氢钠与盐酸反应才有二氧化碳气体生成,利用物质的量的关系并结合图象即可解答.
解答 解:A、向NaOH和Na2CO3混合溶液中滴加盐酸时,首先和NaOH反应生成水和氯化钠,NaOH+HCl=NaCl+H2O,继续滴加时,盐酸和Na2CO3开始反应,首先发生HCl+Na2CO3=NaHCO3+NaCl,不放出气体,继续滴加时,发生反应:NaHCO3+HCl=NaCl+H2O+CO2↑;此时开始放出气体,故A错误;
B、ab段发生反应为:NaHCO3+HCl=NaCl+H2O+CO2↑,反应的离子方程式为:HCO3-+H+=H2O+CO2↑,故B错误;
C、根据碳元素守恒,混合物中,碳酸钠的物质的量是0.01mol,所以两步反应:HCl+Na2CO3=NaHCO3+NaCl,NaHCO3+HCl=NaCl+H2O+CO2↑,分别消耗的盐酸的量是0.01mol,0.1mol•L-1稀盐酸的体积分别是0.1L,所以a=0.3,故C正确;
D、原混合溶液中NaOH与Na2CO3的物质的量分别是0.02mol和0.01mol,物质的量之比为2:1,故D错误.
故选C.
点评 此题考查了元素化合物、图象数据的处理知识,解答此题的易错点是,不能准确理解向碳酸钠溶液中滴加盐酸的反应.是分步进行的,首先发生的是HCl+Na2CO3=NaHCO3+NaCl;进行完全后,再发生:NaHCO3+HCl=NaCl+H2O+CO2↑.

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案
相关题目
11.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 1mol Mg 在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为NA | |
| B. | 14g分子式为CnH2n的链烃中含有的C-H键的数目为2NA | |
| C. | 室温时,1.0 L pH=13的Ba(OH)2溶液中含有OH-的数目为0.2NA | |
| D. | Fe与水蒸气反应生成22.4L氢气,转移电子数为2NA |
11.反应2SO2+O2?2SO3在密闭容器中达到化学平衡时,下列关于说法错误的是( )
| A. | SO3的生成速率等于它的消耗速率 | B. | v(SO2)正=2v(O2)逆 | ||
| C. | 各组分的反应速率均相等 | D. | 反应体系中混合物的组成保持不变 |
15.为了提纯下列物质(括号内为杂质),所选除杂试剂,分离方法,必用仪器都正确的是( )
| 选项 | 不纯物质 | 除杂试剂 | 分离方法 | 必用仪器 |
| A | 碘(水) | 四氯化碳 | 萃取 | 分液漏斗 |
| B | 氯化钾(氯化钙) | 适量盐酸 | 过滤 | 玻璃棒 |
| C | 硝酸铜(硝酸银) | 适量铜粉 | 结晶 | 酒精灯 |
| D | 硫酸钾(碳酸钾) | 适量盐酸 | 蒸馏 | 温度计 |
| A. | A | B. | B | C. | C | D. | D |
5.下列图象错误的是( )
 | 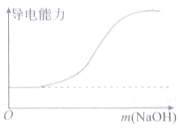 |
| A.向100mL 0.1mol•L-1H2SO4溶液中滴加 0.1mol•L-1Ba(OH)2溶液至过量 | B.向100mL 0.1mol•L-1H2SO4溶液中加入NaOH固体 |
 |  |
| C.向一定浓度的氯化钠溶液中加水 | D.向蒸馏水中通入HCl气体 |
| A. | A | B. | B | C. | C | D. | D |
12.下列说法或做法正确的是( )
| A. | 正常雨水pH等于7,酸雨的PH小于7 | |
| B. | 金属钠着火燃烧时,用泡沫灭火器灭火 | |
| C. | 铝比铁活泼,所以铝比铁更容易被腐蚀 | |
| D. | CO2通入可溶性硅酸盐中析出硅酸沉淀,所以硅酸的酸性小于碳酸 |
10.铁及其化合物在生产和生活中有广泛的应用.
Ⅰ、高铁酸钠(Na2FeO4)是一种新型净水剂,工业上制备高铁酸钠的反应原理为:
Fe(OH)3+NaClO+NaOH→Na2FeO4+X+H2O(未配平),则X的电子式为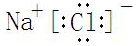 ,反应中被氧化的物质是Fe(OH)3(写化学式).
,反应中被氧化的物质是Fe(OH)3(写化学式).
Ⅱ、铁红颜料跟某些油料混合,可以制成防锈油漆.工业制硫酸产生的硫酸渣中主要含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如图:
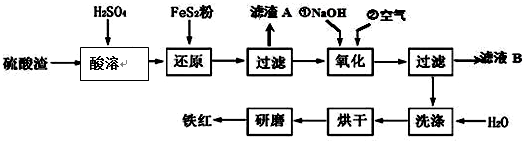
已知:
已知FeS2是一种黄色难溶于水的固体.
(1)酸溶过程中Fe2O3与稀硫酸反应的化学方程式为Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;“滤渣A”主要成份的化学式为SiO2.
(2)还原过程中加入FeS2的目的是将溶液中的Fe3+还原为Fe2+,而本身被氧化为H2SO4,写出该反应的离子方程式FeS2+14Fe3++8H2O═15Fe2++2SO42-+16H+.
(3)为确保铁红的质量和纯度,氧化过程中加NaOH调节溶液pH的范围是3.2~3.8;如果加NaOH调节溶液pH=a,则滤液B中c(Fe3+)=4×10(4-3a)mol/L(25℃时,Ksp=4×10-38)
(4)以甲醚、空气、氢氧化钾溶液为原料,石墨为电极可以构成燃料电池.该电池负极的电极反应式为CH3OCH3+16OH--12e-=2CO32-+11H2O.
Ⅰ、高铁酸钠(Na2FeO4)是一种新型净水剂,工业上制备高铁酸钠的反应原理为:
Fe(OH)3+NaClO+NaOH→Na2FeO4+X+H2O(未配平),则X的电子式为
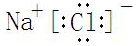 ,反应中被氧化的物质是Fe(OH)3(写化学式).
,反应中被氧化的物质是Fe(OH)3(写化学式).Ⅱ、铁红颜料跟某些油料混合,可以制成防锈油漆.工业制硫酸产生的硫酸渣中主要含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如图:

已知:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
(1)酸溶过程中Fe2O3与稀硫酸反应的化学方程式为Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;“滤渣A”主要成份的化学式为SiO2.
(2)还原过程中加入FeS2的目的是将溶液中的Fe3+还原为Fe2+,而本身被氧化为H2SO4,写出该反应的离子方程式FeS2+14Fe3++8H2O═15Fe2++2SO42-+16H+.
(3)为确保铁红的质量和纯度,氧化过程中加NaOH调节溶液pH的范围是3.2~3.8;如果加NaOH调节溶液pH=a,则滤液B中c(Fe3+)=4×10(4-3a)mol/L(25℃时,Ksp=4×10-38)
(4)以甲醚、空气、氢氧化钾溶液为原料,石墨为电极可以构成燃料电池.该电池负极的电极反应式为CH3OCH3+16OH--12e-=2CO32-+11H2O.