题目内容
1.100mL 1mol•L-1Al2(SO4)3溶液中,含Al3+离子的物质的量( )| A. | 0.1mol | B. | 0.2mol | C. | 0.3mol | D. | 0.4mol |
分析 1mol•L-1Al2(SO4)3溶液中,c(Al3+)=2mol/L,c(SO42-)=3mol/L,根据n=cV计算Al3+离子的物质的量,由此分析解答.
解答 解:1mol•L-1Al2(SO4)3溶液中,c(Al3+)=2mol/L,c(SO42-)=3mol/L,则100mL该溶液中,n(Al3+)=0.1L×2mol/L=0.2mol;故选:B.
点评 本题考查了根据物质的量浓度计算物质的量,根据物质的组成来计算有关离子的物质的量,难度不大.

练习册系列答案
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案
相关题目
17.下列溶液中的Cl-浓度与50mL 1mol•L-1 MgCl2溶液中的Cl-浓度相等的是( )
| A. | 150mL 2mol•L-1 KClO3溶液 | B. | 75mL 2mol•L-1CaCl2溶液 | ||
| C. | 150mL 2mol•L-1 KCl溶液 | D. | 75mL 1mol•L-1AlCl3溶液 |
12.溴酸银(AgBrO3)溶解度随温度变化曲线如图所示,下列说法错误的是( )
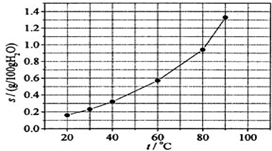

| A. | 温度升高时溴酸银溶解速度加快 | |
| B. | 若硝酸钾中含有少量溴酸银,可用重结晶方法提纯 | |
| C. | 60℃时溴酸银的Ksp约等于6×10-4 | |
| D. | 溴酸银的溶解是放热过程 |
16.下列热化学方程式书写正确的是(△H的绝对值均正确)( )
| A. | C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5KJ•mol-1(燃烧热) | |
| B. | C2H5OH+3O2═2CO2+3H2O△H=-1368.8KJ•mol-1(反应热) | |
| C. | 2NaOH(aq)+H2SO4(aq)═Na2SO4(aq)+2H2O (l)△H=-114.6KJ•mol-1(中和热) | |
| D. | 2H2O(g)═2H2(g)+O2(g)△H=+483.6KJ•mol-1(反应热) |
6.物质结构理论推出:金属晶体中金属阳离子与自由电子之间的强烈的相互作用,叫金属键.金属键越强,其金属的硬度越大,熔、沸点越高,且据研究表明,一般说来金属原子半径越小,价电子数越多,则金属键越强.由此判断下列说法错误的是( )
| A. | 镁的硬度小于铝 | B. | 镁的熔、沸点低于钙 | ||
| C. | 镁的硬度大于钾 | D. | 钙的熔、沸点高于钾 |
13.下列叙述正确的是( )
| A. | 碱金属元素单质的熔点随核电荷数增大而升高 | |
| B. | 同一周期元素的原子,半径越小越容易失去电子 | |
| C. | 第ⅥA族元素的氢化物相对分子质量越大,沸点越高 | |
| D. | 卤族元素的原子序数越大,其单质的沸点一定越高 |
10.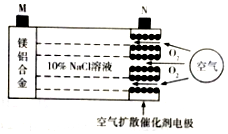 中科院宁波材料所研发金属空气电池获得重大突破.该电池的工作原理如图所示:下列有关说法正确的是( )
中科院宁波材料所研发金属空气电池获得重大突破.该电池的工作原理如图所示:下列有关说法正确的是( )
 中科院宁波材料所研发金属空气电池获得重大突破.该电池的工作原理如图所示:下列有关说法正确的是( )
中科院宁波材料所研发金属空气电池获得重大突破.该电池的工作原理如图所示:下列有关说法正确的是( )| A. | 电池工作时,负极附近溶液的pH升高 | |
| B. | 电池工作时,电流由M极经外电路流向N极 | |
| C. | 电路中转移2mol电子,理论上约消耗标准状况下空气56L | |
| D. | 电池总反应为4Al+3O2=2Al2O3、2Mg+O2=2MgO |
11.下列离子方程式书写正确的是( )
| A. | 碳酸钙溶于盐酸:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 钠投入水中:Na+H2O═Na++2OH-+H2↑ | |
| C. | 铁粉加入稀硫酸中:2Fe+6H+═2Fe3++3H2↑ | |
| D. | 氢氧化钡溶液滴入稀硫酸中:Ba2++SO42-═BaSO4↓ |