题目内容
14.用电子式表示下列物质:CaCl2

H2S:

NaOH:
 .
.
分析 氯化钙是离子化合物,离子化合物中阴离子写出电荷及电性并用“[]”括起来,阳离子写出电荷和电性即可,离子都满足8电子稳定结构;
硫化氢为共价化合物,共价化合物的电子式需要标出最外层电子;
氢氧化钠为离子化合物,钠离子直接用离子符号表示,氢氧根离子需要标出所带电荷及最外层电子.
解答 解:CaCl2为离子化合物,由钙离子和氯离子构成,其电子式为 ,故答案为:
,故答案为: ;
;
H2S为共价化合物,S原子最外层达到8电子稳定结构,其电子式为 ,故答案为:
,故答案为: ;
;
NaOH为离子化合物,钠离子直接用离子符号表示,氢氧根离子为阴离子,需要标出所带电荷及最外层电子,氢氧化钠的电子式为 ,
,
故答案为: .
.
点评 本题考查电子式的书写,题目难度不大,明确电子式的书写原则为解答关键,注意掌握离子化合物与共价化合物的电子式的区别,试题侧重考查学生的规范答题能力.

练习册系列答案
相关题目
5.表是某城市空气质量每周公报的部分内容.下列选项中不会对表中3个空气质量指标产生影响的是( )
| 项目 | 空气污染指数(API) | 空气质量级别 | 空气质量描述 |
| 总悬浮颗粒 | 52 | Ⅱ | 良 |
| 二氧化硫 | 7 | I | 优 |
| 二氧化氮 | 24 | I | 优 |
| A. | 用煤和石油产品作燃料 | B. | 汽车排放的尾气 | ||
| C. | 使用含磷洗衣粉 | D. | 焚烧垃圾 |
2.关于溶液的下列说法正确的是( )
| A. | 等体积、对物质的量浓度的NaX和弱酸HX混合后的溶液中:C(Na+)>c(HX)>c(X-)>c(H+)>c(OH-) | |
| B. | 等物质的量浓度的下列溶液:①H2CO3②Na2CO3③NaHCO3④(NH4)2CO3中c(CO32-)的大小关系为:②>④>③>① | |
| C. | 往0.1mol/L CH3COOH溶液中通入少量HCl,醋酸的电离平衡向逆反应方向移动,且溶液中$\frac{c(C{H}_{3}COOH)}{c({H}^{+})•c(C{H}_{3}CO{O}^{-})}$增大 | |
| D. | Na2CO3溶液中,2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
9.草酸钴用途广泛,可用于指示剂和催化剂的制备.一种利用水钴矿制取草酸钴晶体(CoC2O4?2H2O)工艺流程如图1:
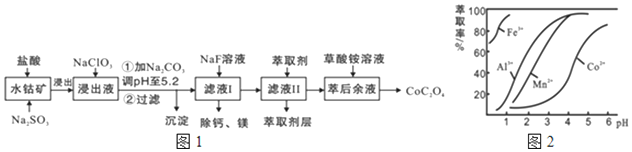
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
(1)浸出过程中加入Na2SO3的 离子方程式为2Co3++SO32-+H2O=2Co2++SO42-+2H+
(2)NaClO3的作用是将Fe2+氧化为Fe3+; 调PH至5.2,沉淀的主要成分为Al(OH)3、Fe(OH)3
(3)萃取剂对金属离子的萃取率与pH的关系如图2所示.滤液Ⅱ中加入萃取剂的作用是除去Mn2+;使用萃取剂适宜的pH是B
A.接近2.0 B.接近3.0 C.接近5.0
(4)除钙、镁是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀,已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10.当加入过量NaF后,所得滤液c(Mg2+):c(Ca2+)=0.7.
(5)已知含钴废料中含Co2O3质量分数为a%,若取mkg该含钴废料按照上述流程,理论上最多能制得草酸钴晶体的质量为$\frac{1830ma}{83}$或16.6mag.

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的PH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(2)NaClO3的作用是将Fe2+氧化为Fe3+; 调PH至5.2,沉淀的主要成分为Al(OH)3、Fe(OH)3
(3)萃取剂对金属离子的萃取率与pH的关系如图2所示.滤液Ⅱ中加入萃取剂的作用是除去Mn2+;使用萃取剂适宜的pH是B
A.接近2.0 B.接近3.0 C.接近5.0
(4)除钙、镁是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀,已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10.当加入过量NaF后,所得滤液c(Mg2+):c(Ca2+)=0.7.
(5)已知含钴废料中含Co2O3质量分数为a%,若取mkg该含钴废料按照上述流程,理论上最多能制得草酸钴晶体的质量为$\frac{1830ma}{83}$或16.6mag.
19.表为元素周期表的一部分用元素符号或化学式回答下列问题.
(1)写出⑥与⑦元素以原子个数1:2组成分子的电子式: ;
;
用电子式表示③与④两种元素对应化合物的形成过程: .
.
(2)①的气态氢化物与其最高价氧化物水化物反应的离子方程式为NH3+H+=NH4+,第三周期中除⑩元素以外离子半径最小的是Al3+(填离子符号).
(3)②③⑤三种元素最高价氧化物对应的水化物碱性最强的是KOH (填化学式),这三种碱性物质中有(填:“有”或“没有”)相互能发生的反应,若回答“有”,写出对应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O.
(4)元素⑧的单质与②⑨形成的化合物的溶液反应的离子方程式为Cl2+2Br-=2Cl-+Br2.在反应后的溶液中加入有机溶剂CCl4,震荡后静置的实验现象为溶液分层,下层为橙红色,上层为无色.
(5)与②同主族,第三周期的元素单质在⑦的单质中燃烧生成的化合物的电子式 ;④⑧⑨元素的离子的还原性由强到弱顺序为Br->Cl->F-(用离子符号).
;④⑧⑨元素的离子的还原性由强到弱顺序为Br->Cl->F-(用离子符号).
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑥ | ① | ⑦ | ④ | ||||
| 3 | ③ | ⑤ | ⑧ | ⑩ | ||||
| 4 | ② | ⑨ |
 ;
;用电子式表示③与④两种元素对应化合物的形成过程:
 .
.(2)①的气态氢化物与其最高价氧化物水化物反应的离子方程式为NH3+H+=NH4+,第三周期中除⑩元素以外离子半径最小的是Al3+(填离子符号).
(3)②③⑤三种元素最高价氧化物对应的水化物碱性最强的是KOH (填化学式),这三种碱性物质中有(填:“有”或“没有”)相互能发生的反应,若回答“有”,写出对应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O.
(4)元素⑧的单质与②⑨形成的化合物的溶液反应的离子方程式为Cl2+2Br-=2Cl-+Br2.在反应后的溶液中加入有机溶剂CCl4,震荡后静置的实验现象为溶液分层,下层为橙红色,上层为无色.
(5)与②同主族,第三周期的元素单质在⑦的单质中燃烧生成的化合物的电子式
 ;④⑧⑨元素的离子的还原性由强到弱顺序为Br->Cl->F-(用离子符号).
;④⑧⑨元素的离子的还原性由强到弱顺序为Br->Cl->F-(用离子符号).
6.下列描述中正确的是( )
| A. | CS2为V形的极性分子 | |
| B. | ClO3-的空间构型为平面三角形 | |
| C. | SF6中所有原子均满足8电子稳定结构 | |
| D. | SiF4和SO32-的中心原子均为印sp3杂化 |
3.下列对有机化合物用途的说法中,正确的是( )
| A. | 医用消毒酒精的体积分数为95% | |
| B. | 常用福尔马林溶液保存动物标本 | |
| C. | 医院常用银氨溶液检验病人的尿糖 | |
| D. | 工业上常用乙烷和氯气反应制取氯乙烷 |
15.下列有关原电池的叙述中正确的是( )
| A. | 在原电池的外电路中,电子由正极通过导线流向负极 | |
| B. | 在原电池的电解质溶液中,阳离子向负极移动 | |
| C. | 锌锰子电池是一种常用的一次性电池 | |
| D. | 氢氧燃料电池中氢气在负极发生氧化反应 |
