题目内容
9.为了探究化学反应速率和化学反应限度的有关问题,某研究小组进行了以下实验:| 序号 | 反应温度/℃ | C(H2O2)/mol-L | V(H2O2)/mL | M(MnO2)/g | t/min |
| 1 | 20 | 2 | 10 | 0 | t1 |
| 2 | 20 | 2 | 10 | 0.1 | t2 |
| 3 | 20 | 4 | 10 | 0.1 | t3 |
| 4 | 40 | 2 | 10 | 0.1 | t4 |
(2)为研究温度对化学反应速率的影响,可以将实验2和实验4作对比(填序号).
(3)将实验1和实验2作对比,t1>t2(填“>”、“<”或“=”).
分析 (1)实验2和实验3是双氧水的浓度不同;
(2)实验2和实验4其他条件都相同,只有温度不同;
(3)试验1和实验2相比较,2中使用了催化剂,其他条件相同.
解答 解:(1)实验2和实验3是双氧水的浓度不同,则实验目的为研究双氧水浓度不同,对化学反应速率的影响,
故答案为:H2O2的浓度;
(2)实验2和实验4其他条件都相同,只有温度不同,这两个实验是研究温度对化学反应速率的影响,
故答案为:2;4;
(3)试验1和实验2相比较,2中使用了催化剂,其他条件相同,反应速率大,所用时间短,
故答案为:>.
点评 本题考查了影响化学反应速率的因素的探究,注意熟练掌握影响化学反应速率的因素,利用控制变量法是解本题的关键,题目难度不大.

练习册系列答案
相关题目
9.烷烃CH3CH2CH(CH2CH2CH3)CH(CH3)CH3的命名正确的是( )
| A. | 4-甲基-3-丙基戊烷 | B. | 3-异丙基己烷 | ||
| C. | 2-甲基-3-丙基戊烷 | D. | 2-甲基-3-乙基己烷 |
10.依据下列实验现象,不能得出对应结论的是( )
| 实验 | 现象 | 结论 | |
| A | 室温下测0.1mol•L-1醋酸pH | pH≈3.3 | 醋酸是弱酸 |
| B | 向2mL 0.1mol•L-1NaOH溶液中 i.滴加几滴同浓度的MgSO4溶液 ii.再滴加几滴同浓度FeCl3溶液 | i.产生白色沉淀 ii.产生红褐色沉淀 | 溶解度:Fe(OH)3<Mg(OH)2 |
| C | 常温下,将CO2通入苯酚钠溶液中 | 溶液变浑浊 | 酸性:碳酸>苯酚 |
| D | 将少量溴乙烷与NaOH溶液共热,冷却、HNO3酸化后,滴加AgNO3溶液 | 淡黄色沉淀 | 证明含有溴元素 |
| A. | A | B. | B | C. | C | D. | D |
1.在一定条件下的定容密闭容器中反应:A(s)+2B(g)?C(g)+D(g),当下列物理量不再变化时,不能表明该反应已达平衡的是( )
| A. | 混合气体的压强 | B. | 混合气体的密度 | ||
| C. | B的物质的量浓度 | D. | 混合气体的平均相对分子质量 |
18.下列关于吸热反应的分析正确的是( )
| A. | 生成物化学键形成时也会吸收热量 | |
| B. | 生成物的总能量高于反应物的总能量 | |
| C. | 一定需要加热条件下才能实现 | |
| D. | 使用催化剂可以降低吸热反应的热效应 |
19.表为元素周期表的一部分用元素符号或化学式回答下列问题.
(1)写出⑥与⑦元素以原子个数1:2组成分子的电子式: ;
;
用电子式表示③与④两种元素对应化合物的形成过程: .
.
(2)①的气态氢化物与其最高价氧化物水化物反应的离子方程式为NH3+H+=NH4+,第三周期中除⑩元素以外离子半径最小的是Al3+(填离子符号).
(3)②③⑤三种元素最高价氧化物对应的水化物碱性最强的是KOH (填化学式),这三种碱性物质中有(填:“有”或“没有”)相互能发生的反应,若回答“有”,写出对应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O.
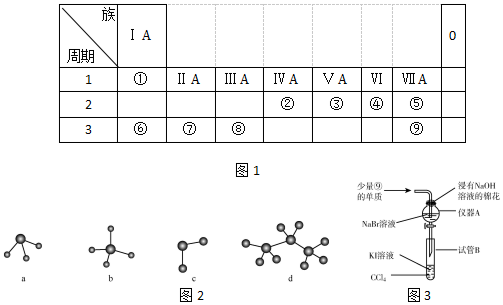
(4)元素⑧的单质与②⑨形成的化合物的溶液反应的离子方程式为Cl2+2Br-=2Cl-+Br2.在反应后的溶液中加入有机溶剂CCl4,震荡后静置的实验现象为溶液分层,下层为橙红色,上层为无色.
(5)与②同主族,第三周期的元素单质在⑦的单质中燃烧生成的化合物的电子式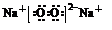 ;④⑧⑨元素的离子的还原性由强到弱顺序为Br->Cl->F-(用离子符号).
;④⑧⑨元素的离子的还原性由强到弱顺序为Br->Cl->F-(用离子符号).
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑥ | ① | ⑦ | ④ | ||||
| 3 | ③ | ⑤ | ⑧ | ⑩ | ||||
| 4 | ② | ⑨ |
 ;
;用电子式表示③与④两种元素对应化合物的形成过程:
 .
.(2)①的气态氢化物与其最高价氧化物水化物反应的离子方程式为NH3+H+=NH4+,第三周期中除⑩元素以外离子半径最小的是Al3+(填离子符号).
(3)②③⑤三种元素最高价氧化物对应的水化物碱性最强的是KOH (填化学式),这三种碱性物质中有(填:“有”或“没有”)相互能发生的反应,若回答“有”,写出对应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O.
(4)元素⑧的单质与②⑨形成的化合物的溶液反应的离子方程式为Cl2+2Br-=2Cl-+Br2.在反应后的溶液中加入有机溶剂CCl4,震荡后静置的实验现象为溶液分层,下层为橙红色,上层为无色.
(5)与②同主族,第三周期的元素单质在⑦的单质中燃烧生成的化合物的电子式
 ;④⑧⑨元素的离子的还原性由强到弱顺序为Br->Cl->F-(用离子符号).
;④⑧⑨元素的离子的还原性由强到弱顺序为Br->Cl->F-(用离子符号). 
 .
. →
→ ,元素⑥和⑨形成的化合物中含有离子键.
,元素⑥和⑨形成的化合物中含有离子键.