题目内容
15.下列反应的离子方程式错误的是( )| A. | 稀硝酸和过量铁屑反应 3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O | |
| B. | 氯化铝溶液和过量的氨水反应 Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| C. | 碳酸钠溶液中加入过量苯酚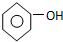 +CO32-→ +CO32-→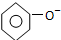 +HCO3- +HCO3- | |
| D. | 次氯酸钙溶液中通入过量CO2 ClO-+CO2+H2O═HClO+HCO3- |
分析 A.反应生成硝酸亚铁、NO和水;
B.反应生成氢氧化铝和氯化铵;
C.反应生成苯酚钠和碳酸氢钠;
D.反应生成碳酸氢钙和HClO.
解答 解:A.稀硝酸和过量铁屑反应的离子反应为 3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O,遵循电子、电荷守恒,故A正确;
B.氯化铝溶液和过量的氨水反应的离子反应为Al3++3NH3.H2O=Al(OH)3↓+3NH4+,故B错误;
C.碳酸钠溶液中加入过量苯酚的离子反应为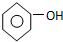 +CO32-→
+CO32-→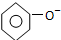 +HCO3-,故C正确;
+HCO3-,故C正确;
D.次氯酸钙溶液中通入过量CO2 的离子反应为ClO-+CO2+H2O═HClO+HCO3-,故D正确;
故选B.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质,选项A为易错点,题目难度不大.

练习册系列答案
相关题目
5.下列指定反应的离子方程式正确的是( )
| A. | 向Na2O2中加入足量水:2Na2O2+2H2O=4Na++4OH-+O2↑ | |
| B. | 向Ag(NH3)2NO3溶液中加入盐酸:Ag(NH3)2++2H+=Ag++2NH4+ | |
| C. | 向Al2(SO4)3溶液中加入过量氨水:Al3++3OH-=Al(OH)3↓ | |
| D. | 向Ca(HCO3)2溶液中加入澄清石灰水:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O |
6.根据下列实验操作和现象所得到的结论正确的是( )
| 选项 | 实验操作和现象 | 结论 |
| A | 向Na2SiO3溶液中滴加几滴酚酞,然后逐滴加入稀盐酸至红色褪去,2min后,试管里出现凝胶 | 非金属性:Cl>Si |
| B | 取久置的Na2O2粉末,向其中滴加过量的盐酸后产生气体 | Na2O2没有变质 |
| C | 溴乙烷与NaOH溶液共热后,加入AgNO3溶液,未出现淡黄色沉淀 | 溴乙烷没有水解 |
| D | 向NaAlO2溶液中滴入NaHCO3溶液,产生白色沉淀 | AlO2-结合H+的能力比CO32-强 |
| A. | A | B. | B | C. | C | D. | D |
19.下列物质:(1)Na(2)Br2 (3)Na2O (4)NO2(5)CO2(6)SO3(7)NH3(8)H2S(9)HCl (10)H2SO4 (11)Ba(OH)2(12)NaCl(13)蔗糖 (14)NaCl溶液,其中属于电解质的是( )
| A. | (1)(3)(6)(8)(9)(11) | B. | (2)(3)(6)(10)(11)(13) | C. | (3)(8)(9)(10)(11)(12) | D. | (4)(5)(7)(10)(11)(14) |
 .
.