题目内容
7.已知体积为2L的恒容密闭容器中发生反应:2SO2(g)+O2(g)?2SO3(g),请根据化学反应的有关原理同答下列问题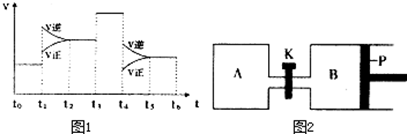
(1)一定条件下,充入2mol SO2(g)和2mol O2(g),20s后,测得SO2的体积百分含量为12.5%,则用SO2表示该反应在这20s内的反应速率为0.04mol/(L•s)
(2)下面的叙述可作为判断可逆反应达到平衡状态依据的是(填序号)②④.
①混合气体的密度不变 ②混合气体的平均相对分子质量不变
③v正(SO2)=2v正(O2) ④各气体的浓度都不再发生变化
(3)图1表示该反应的速率(v)随时间(t)的变化的关系.则下列不同时间段中,SO3的百分含量最高的是B
A、t2→t3 B、t0→t1 C、t5→t6 D、t3→t4
据图分析:你认为t3时改变的外界条件可能是加入催化剂;
(4)图2中P是可自由平行滑动的活塞.在相同温度时,向A容器中充入4mol SO3(g),关闭K,向B容器中充入2mol SO3(g),两容器分别发生反应.已知起始时容器A和B的体积均为aL.试回答:
①反应达到平衡时容器B的体积为1.2a L,容器B中SO3转化率为40%
②若打开K,一段时间后重新达到平衡,容器B的体积为2.6aL(连通管中气体体积忽略不计,且不考虑温度的影响).
分析 (1)一定条件下,充入2.0mol SO2(g) 和2.0mol O2(g),20s后达平衡,测得SO3的体积分数为12.5%,则:
2SO2(g)+O2(g)?2SO3(g)
起始量(mol):2 2 0
变化量(mol):2x x 2x
平衡量(mol):2-2x 2-x 2x
故$\frac{2-2x}{4-x}$=12.5%,解得x=0.8,再根据v=$\frac{△c}{△t}$计算v(SO2);
(2)结合平衡的特征“等、定”及衍生的物理量判断;
(3)t0→t1为原平衡,A、C中平衡逆向移动,D中平衡不移动,所以t3时使用催化剂;
(4)根据恒温恒压条件下,气体的物质的量之比等于容器的容积之比计算出消耗的三氧化硫的物质的量;根据等效平衡的知识判断6mol三氧化硫达到平衡时容器的体积,然后计算出打开K后容器B的体积.
解答 解:(1)一定条件下,充入2.0mol SO2(g) 和2.0mol O2(g),20s后达平衡,测得SO3的体积分数为12.5%,则:
2SO2(g)+O2(g)?2SO3(g)
起始量(mol):2 2 0
变化量(mol):2x x 2x
平衡量(mol):2-2x 2-x 2x
故$\frac{2-2x}{4-x}$=12.5%,解得x=0.8,
v(SO2)=$\frac{\frac{0.8mol×2}{2L}}{20s}$=0.04mol/(L•s),
故答案为:0.04mol/(L•s);
(2)①m、V不变,则混合气体的密度不变,不能判定平衡,故不选;
②n为变量,则混合气体的平均相对分子质量不变,可判定平衡,故选;
③v正(SO2)=2v正(O2),不能判断正逆反应速率关系,不能判断,故不选;
④各气体的浓度都不再发生变化,为平衡状态,故选;
故答案为:②④;
(3)t0→t1为原平衡,A、C中平衡逆向移动,D中平衡不移动,则B中SO3的百分含量最高,所以t3时使用催化剂,故答案为:B;加入催化剂;
(4)①反应达到平衡时容器B的体积为1.2a L,B为恒压条件下,容器的容积与气体的物质的量成正比,说明达到平衡时气体的物质的量为反应前的1.2倍,即平衡时混合气体的物质的量为2.4mol,气体物质的量之间了0.2mol,设反应消耗了三氧化硫nmol,则
2SO3(g)?2SO2(g)+O2(g)△n
2 2 1 1mol
n 0.4mol
n=0.8mol,三氧化硫的转化率为:$\frac{0.8mol}{2L}$×100%=40%,
故答案为:40%;
②若打开K,一段时间后重新达到平衡,在恒温恒压条件下,与向B中进入6mol三氧化硫达到的平衡为等效平衡,所以达到平衡时整个容器的容积为:$\frac{6mol}{2mol}$×1.2a=3.6a,所以容器B的体积为:3.6a-a=2.6a,
故答案为:2.6a.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、转化率及速率计算为解答的关键,侧重分析与计算能力的考查,注意图象分析及平衡移动分析,题目难度不大.

 阅读快车系列答案
阅读快车系列答案| A. | CH3-O-CH3 | B. | (CH3)3C-CH2-O-CH3 | ||
| C. | (CH3)3C-CH2-O-CH2-C(CH3)3 | D. | (CH3)2C=CH(CH3) |
| A. | 稀硝酸和过量铁屑反应 3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O | |
| B. | 氯化铝溶液和过量的氨水反应 Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| C. | 碳酸钠溶液中加入过量苯酚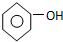 +CO32-→ +CO32-→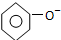 +HCO3- +HCO3- | |
| D. | 次氯酸钙溶液中通入过量CO2 ClO-+CO2+H2O═HClO+HCO3- |
| A. | 未来化学的研究方向是经验化 | B. | 化学不需要再做实验 | ||
| C. | 化学不再是纯实验学科 | D. | 化学不做实验,就什么都不知道 |
| A. | $\frac{(b-a)}{V}$ | B. | $\frac{(2b-a)}{V}$ | C. | $\frac{2(b-a)}{V}$ | D. | $\frac{2(2b-a)}{V}$ |
| A. | 互为手性异构体的分子互为镜像 | |
| B. | 利用手性催化剂合成可主要得到一种手性分子 | |
| C. | 手性异构体分子组成相同 | |
| D. | 手性异构体性质相同 |
 +
+ $\stackrel{△}{→}$
$\stackrel{△}{→}$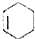
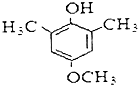 .
.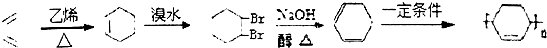 .(合成路线常用的表示方式为:A$→_{反应条件}^{反应试剂}$B$→_{反应条件}^{反应试剂}$…目标产物)
.(合成路线常用的表示方式为:A$→_{反应条件}^{反应试剂}$B$→_{反应条件}^{反应试剂}$…目标产物)