题目内容
在4L密闭容器中充入6mol A气体和5mol B气体,在一定条件下发生反应:3A(g)+B(g)?2C(g)+xD(g),达到平衡时,生成了2mol C,经测定D的浓度为0.5mol?L-1,下列判断正确的是( )
| A、X=3 |
| B、A的转化率为50% |
| C、平衡时B的浓度为1.5 mol?L-1 |
| D、达到平衡时,在相同温度下容器内混合气体的压强是反应前的95% |
考点:化学平衡的计算
专题:化学平衡专题
分析:到平衡时,生成了2molC,D的物质的量为4L×0.5mol/L=2mol,
3A(g)+B(g)?2C(g)+xD(g)
起始:6mol 5mol 0 0
转化:3mol 1mol 2mol xmol
平衡:3mol 4mol 2mol 2mol
进而可计算平衡时各物质的浓度、转化率等物理量,以此解答该题.
3A(g)+B(g)?2C(g)+xD(g)
起始:6mol 5mol 0 0
转化:3mol 1mol 2mol xmol
平衡:3mol 4mol 2mol 2mol
进而可计算平衡时各物质的浓度、转化率等物理量,以此解答该题.
解答:
解:达到平衡时,生成了2molC,D的物质的量为4L×0.5mol/L=2mol,
3A(g)+B(g)?2C(g)+xD(g)
起始:6mol 5mol 0 0
转化:3mol 1mol 2mol xmol
平衡:3mol 4mol 2mol 2mol
A.由以上分析可知x=2,故A错误;
B.A的转化率为
×100%=50%,故B正确;
C.平衡时B的浓度为
=1mol/L,故C错误;
D.反应前后气体的物质的量不变,则压强不变,故D错误.
故选B.
3A(g)+B(g)?2C(g)+xD(g)
起始:6mol 5mol 0 0
转化:3mol 1mol 2mol xmol
平衡:3mol 4mol 2mol 2mol
A.由以上分析可知x=2,故A错误;
B.A的转化率为
| 3 |
| 6 |
C.平衡时B的浓度为
| 4 |
| 4 |
D.反应前后气体的物质的量不变,则压强不变,故D错误.
故选B.
点评:本体考查化学平衡的计算吗,题目难度不大,本题注意根据三段式法计算较为直观.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
常温条件下,下列溶液中的各组离子一定能够大量共存的是( )
| A、pH=1的溶液:Na+、Fe2+、Cl-、NO3- | ||
| B、含有大量I-的溶液:ClO-、Na+、Cl-、CO32- | ||
C、
| ||
| D、加入铝粉能放出大量H2的溶液:K+、NH4+、SO42-、CO32- |
下列说法正确的是( )
| A、二氧化硫的排放是造成光化学烟雾的主要因素 |
| B、NH3的沸点高于PH3,是因为N-H比P-H牢固 |
| C、凡是吸热反应都不能自发进行 |
| D、在PH=1的溶液中:K+、Fe2+、Cl-、NO3-等离子一定不能大量共存 |
用硫铁矿生产硫酸的过程中,对提高效率不利的因素是( )
| A、矿石粉碎后送入沸腾炉 |
| B、使用热交换器预热气体 |
| C、使用催化剂 |
| D、用水吸收三氧化硫 |
下列实验事实不能说明醋酸是弱电解质的是( )
| A、醋酸溶液的导电性比盐酸弱 |
| B、0.01ml/L醋酸溶液PH>2 |
| C、CH3COONa溶液PH>7 |
| D、将PH=3醋酸溶液稀释100倍,稀释后溶液PH:3<PH<5 |
下列关于电解池的叙述不正确的是( )
| A、在电解池的阴极发生还原反应 |
| B、与电源负极相连的是电解池的阳极 |
| C、阴离子移向电解池的阳极 |
| D、电子从电源的负极沿导线流入电解池的阴极 |
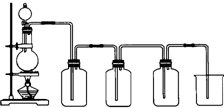 已知硝酸能把铁氧化成Fe(NO3)3,但当铁过量时,产物是Fe(NO3)2.某同学受此启发,提出一个相似的观点:即当足量Cl2与铁反应时则生成FeCl3,当少量Cl2与足量铁反应时则生成FeCl2.为验证该观点是否正确,该同学设计了以下实验.
已知硝酸能把铁氧化成Fe(NO3)3,但当铁过量时,产物是Fe(NO3)2.某同学受此启发,提出一个相似的观点:即当足量Cl2与铁反应时则生成FeCl3,当少量Cl2与足量铁反应时则生成FeCl2.为验证该观点是否正确,该同学设计了以下实验.