题目内容
2.在同温同压下,下列各组热化学方程式中,△H1>△H2的是( )| A. | 2H2(g)+O2(g)═2H2O(l);△H1 2H2(g)+O2(g)═2H2O(g);△H2 | |
| B. | S(g)+O2(g)═2SO2(g);△H1 S(s)+O2(g)═2SO2(g);△H2 | |
| C. | C(s)+$\frac{1}{2}$ O2(g)═CO(g);△H1 C(s)+O2(g)═CO2(g);△H2 | |
| D. | H2(g)+Cl2(g)═2HCl(g);△H1 $\frac{1}{2}$H2(g)+$\frac{1}{2}$ Cl2(g)═HCl(g);△H2 |
分析 选项中均为放热反应,焓变为负,能量为气态>液态>固体,物质的量与热量成正比,完全反应比不完全反应放出热量多,以此来解答.
解答 解:A.反应物相同,水的状态不同,生成液态水放出热量多,焓变为负,则△H2>△H1,故A不选;
B.生成物相同,S的状态不同,气态S的能量高,则反应放热多,焓变为负,则△H2>△H1,故B不选;
C.完全反应比不完全反应放出热量多,焓变为负,则△H1>△H2,故C选;
D.物质的量与热量成正比,物质的量越大,放热越多,焓变为负,则△H2>△H1,故D不选;
故选C.
点评 本题考查反应热与焓变,为高频考点,把握状态、物质的量与焓变的关系为解答的关键,侧重分析与应用能力的考查,注意热量与焓变的区别,题目难度不大.

练习册系列答案
 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案
相关题目
12.下列实验操作和数据记录都正确的是( )
| A. | 用25 mL碱式滴定管量取高锰酸钾溶液,体积为16.60 mL | |
| B. | 用标准NaOH溶液滴定未知浓度盐酸,用去NaOH溶液20.50 mL | |
| C. | 用10 mL量筒量取8.25 mL盐酸 | |
| D. | 用pH试纸测得某溶液pH为3.2 |
10. 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中W所处的周期序数是最外层电子数的一半.下列判断不正确的是( )
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中W所处的周期序数是最外层电子数的一半.下列判断不正确的是( )
 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中W所处的周期序数是最外层电子数的一半.下列判断不正确的是( )
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中W所处的周期序数是最外层电子数的一半.下列判断不正确的是( )| A. | 最简单气态氢化物的热稳定性:R>Q | |
| B. | 最高价氧化物对应水化物的酸性:Q<W | |
| C. | 含T的盐溶液一定显酸性 | |
| D. | 实验室制备T的氢氧化物可以通过R形成的氢化物通入到T离子的溶液中得到 |
14.下列反应中,不属于四种基本反应类型,但属于氧化还原反应的是( )
| A. | 2Cu+O2?2CuO | B. | CH4+2O2 $\frac{\underline{\;点燃\;}}{\;}$ CO2+2H2O | ||
| C. | 2KClO3?2KCl+3O2↑ | D. | CaCO3+2HCl═CaCl2+H2O+CO2↑ |
11.以下是表示反应2A+B=3C+4D的反应速率数据.按照反应快慢顺序排列应为( )
①υ(A)=0.5mol•L-1•S-1 ②υ(B)=0.3mol•L-1•S-1
③υ(C)=0.8mol•L-1•S-1 ④υ(D)=1mol•L-1•S-1.
①υ(A)=0.5mol•L-1•S-1 ②υ(B)=0.3mol•L-1•S-1
③υ(C)=0.8mol•L-1•S-1 ④υ(D)=1mol•L-1•S-1.
| A. | ④>③>①>② | B. | ②>③>①=④ | C. | ②>③>①>④ | D. | ③>②>①=④ |
12.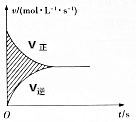 在容积为4L的刚性密闭容器中,进行可逆反应:X(g)+2Y(g)?2Z(g)并达到平衡,在此过程中以Y的浓度改变表示的反应速率v正、v逆与时间t的关系如图所示,则图中阴影部分的面积表示( )
在容积为4L的刚性密闭容器中,进行可逆反应:X(g)+2Y(g)?2Z(g)并达到平衡,在此过程中以Y的浓度改变表示的反应速率v正、v逆与时间t的关系如图所示,则图中阴影部分的面积表示( )
 在容积为4L的刚性密闭容器中,进行可逆反应:X(g)+2Y(g)?2Z(g)并达到平衡,在此过程中以Y的浓度改变表示的反应速率v正、v逆与时间t的关系如图所示,则图中阴影部分的面积表示( )
在容积为4L的刚性密闭容器中,进行可逆反应:X(g)+2Y(g)?2Z(g)并达到平衡,在此过程中以Y的浓度改变表示的反应速率v正、v逆与时间t的关系如图所示,则图中阴影部分的面积表示( )| A. | X的浓度的变化量 | B. | Y的浓度的减小量 | ||
| C. | Z的物质的量的变化量 | D. | Y的物质的量的减小量 |
 烃A是一种重要的化工原料.已知A在标准状况下的密度为1.25g•L-1,B可发生银镜反应.它们之间的转化关系如图:
烃A是一种重要的化工原料.已知A在标准状况下的密度为1.25g•L-1,B可发生银镜反应.它们之间的转化关系如图: