题目内容
16.综合利用CO2、CO对构建低碳社会有重要意义.(1)Li2O、Na2O、MgO均能吸收CO2.如果寻找吸收CO2的其他物质,下列建议合理的是ab.
a.可在碱性氧化物中寻找
b.可在ⅠA、ⅡA族元素形成的氧化物中寻找
c.可在具有强氧化性的物质中寻找
(2)Li4SiO4可用于吸收、释放CO2,原理是:在500℃,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生.写出CO2与Li4SiO4反应的化学方程式CO2+Li4SiO4
 Li2CO3+Li2SiO3;该反应为放(填“吸”或者“放”)热反应,原因是升高温度,平衡向逆向进行,说明逆反应为吸热反应,所以正反应为放热反应.
Li2CO3+Li2SiO3;该反应为放(填“吸”或者“放”)热反应,原因是升高温度,平衡向逆向进行,说明逆反应为吸热反应,所以正反应为放热反应.(3)CO与H2在催化剂作用下发生如下反应:CO(g)+2H2(g)?CH3OH(g).对此反应进行如下研究:某温度下在某2L恒容密闭容器中分别充入1.2mol CO和1mol H2,达到平衡测得有0.4mol CH3OH(g),则该反应平衡常数值为50.
(4)在200℃并用钴做催化剂的条件下,CO与H2可合成C5H12(汽油的一种成分),可减少碳排放.反应中能量变化如图1所示,写出该反应的热化学方程式5CO(g)+11H2(g)═C5H12(g)+5H2O(g)△H=+(b-a)KJ/mol.

(5)如图2所示,利用缺铁氧化物[如Fe0.9O]可实现CO2的综合利用、构建低碳环保社会.请说明该转化的优点将CO2转化为C和O2;利用了太阳能;Fe3O4可循环使用.
分析 (1)二氧化碳为酸性气体,Li2O、Na2O、MgO均能吸收CO2与氧化性无关;
(2)在500℃,CO2与Li4SiO4接触后生成Li2CO3,反应物为CO2与Li4SiO4,生成物有Li2CO3,根据质量守恒可知产物还有Li2SiO3;根据升高温度平衡左移来分析;
(3)利用三段式结合平衡常数的计算公式来计算;
(4)根据图1可知,反应物为5molCO气体和11mol氢气,产物为1mol戊烷气体和5mol水蒸汽,由于反应物的能量低于产物的能量,故此反应为吸热反应,且吸收(b-a)KJ,据此分析;
(5)根据图示可知,Fe0.9O可以将CO2转化为Fe3O4和C,而Fe3O4又在太阳能高温作用下分解为Fe0.9O和氧气,据此分析.
解答 解:(1)a.Li2O、Na2O、MgO均属于碱性氧化物,均能吸收酸性氧化物CO2,可在碱性氧化物中寻找吸收CO2的其他物质,故a正确;
b.Li2O、Na2O、MgO均能吸收CO2,钠、镁为ⅠA、ⅡA族元素,所以可在ⅠA、ⅡA族元素形成的氧化物中寻找吸收CO2的其他物质,故b正确;
c.Li2O、Na2O、MgO均能吸收CO2,但它们都没有强氧化性,且吸收二氧化碳与氧化还原无关,故c错误;
故答案为:ab;
(2)在500℃,CO2与Li4SiO4接触后生成Li2CO3,反应物为CO2与Li4SiO4,生成物有Li2CO3,根据质量守恒可知产物还有Li2SiO3,所以化学方程式为:CO2+Li4SiO4 Li2CO3+Li2SiO3;由于升高温度平衡左移,故正反应为放热反应.
Li2CO3+Li2SiO3;由于升高温度平衡左移,故正反应为放热反应.
故答案为:CO2+Li4SiO4 Li2CO3+Li2SiO3;放;升高温度,平衡向逆向进行,说明逆反应为吸热反应,所以正反应为放热反应;
Li2CO3+Li2SiO3;放;升高温度,平衡向逆向进行,说明逆反应为吸热反应,所以正反应为放热反应;
(3)CO(g)+2H2(g)?CH3OH(g)
起始:1.2mol 1mol 0
转化:0.4mol 0.8mol 0.4mol
平衡:0.8mol 0.2mol 0.4mol
所以:k=$\frac{0.2mol/L}{0.4mol/L×(0.1mol/L)^{2}}$=50(mol/L)-2,故答案为:50;
(4)根据图1可知,反应物为5molCO气体和11mol氢气,产物为1mol戊烷气体和5mol水蒸汽,由于反应物的能量低于产物的能量,故此反应为吸热反应,且吸收(b-a)KJ,故热化学方程式为:5CO(g)+11H2(g)═C5H12(g)+5H2O(g)△H=+(b-a) KJ/mol,故答案为:5CO(g)+11H2(g)═C5H12(g)+5H2O(g)△H=+(b-a) KJ/mol;
(5)根据图示可知,Fe0.9O可以将CO2转化为Fe3O4和C,而Fe3O4又在太阳能高温作用下分解为Fe0.9O和氧气,在此循环过程中,利用了太阳能,Fe3O4可循环使用,且能将CO2转化为C和O2,减少了空气污染.故答案为:将CO2转化为C和O2;利用了太阳能;Fe3O4可循环使用.
点评 本题属于拼合型题目,涉及热化学方程式书写、化学平衡常数的计算、陌生反应的书写等,侧重考查学生对知识的迁移应用,题目计算量大,对学生的心理素质有较高的要求,难度较大.

 阅读快车系列答案
阅读快车系列答案实验流程如下:
化肥$→_{加热}^{辅助试剂}$(NH4)2SO4溶液$→_{吹出}^{NaOH}$NH3$→_{吸收}^{H_{3}BO_{3}}$(NH4)2B4O7溶液→用标准盐酸滴定
步骤:①取10.00g化肥样品溶于水,定容至100mL;
②在烧杯中加入10.00mL步骤①中得到的化肥水溶液和辅助试剂,加热使其充分反应;
③反应完毕,将反应液转移到大试管中;
④按如下装置用水蒸气将NH3吹出,并用H3BO3溶液吸收(加热装置未画出);
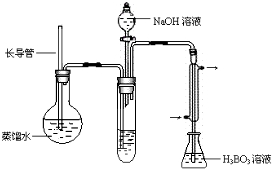
⑤取下锥形瓶,滴加指示剂,用0.2500mol•L-1盐酸标准液滴定;
⑥重复实验操作.
数据记录如下:
| 实验编号 | 样品和辅助试剂 | 消耗盐酸体积(mL) |
| 1 | 10.00mL溶液、0.1g催化剂、20mL浓硫酸 | 33.18 |
| 2 | 10.00mL溶液、0.1g催化剂、20mL浓硫酸 | 33.70 |
| 3 | 10.00mL溶液、0.1g催化剂、20mL浓硫酸 | 33.22 |
| 4 | x |
(1)滴定时(NH4)2B4O7重新转化为H3BO3,反应的化学方程式为(NH4)2B4O7+2HCl+5H2O=4H3BO3+2NH4Cl.H3BO3为一元弱酸,在水中发生反应H3BO3+H2O?[B(OH)4]-+H+.pH相同的硼酸溶液、盐酸中,水的电离程度前者大(填“前者大”、“后者大”或“相同”)
(2)步骤③的实验装置中需要加热的仪器是圆底烧瓶(填仪器名称),长导管的作用是防止装置中压力过大而发生危险,防止冷却时发生倒吸.
(3)编号为4的实验应加入的样品和辅助试剂为10.00mL蒸馏水、0.1g催化剂、20mL浓硫酸,理由是空白、等量对照以消除其他试剂、实验操作等因素引起的误差.
(4)通过计算可得该化肥中的氮含量为116.2-3.5x克/每千克化肥(用含x的代数式表示,要求化简).
| A. | 麦芽糖和蔗糖的水解产物相同 | |
| B. | 用新制的氢氧化铜可区分乙醇、乙醛 | |
| C. | 用高锰酸钾酸性溶液可以区分苯、甲苯 | |
| D. | 用饱和溴水可区分苯酚溶液、己烷、1-己烯 |
| A. | Z的氢化物是同主族简单氢化物中最稳定的 | |
| B. | 非金属性:Z>Y>X | |
| C. | XY2中各原子最外层均满足8电子结构 | |
| D. | X、Y的最高价氧化物对应的水化物酸性后者强 |
| A. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | 由C(金刚石)═C(石墨)△H=-1.9 kJ•mol-1 可知,金刚石比石墨稳定 | |
| C. | 在101 KPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式为:2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ•mol-1 | |
| D. | 在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,若将含0.5 mol H2SO4的浓溶液与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ |
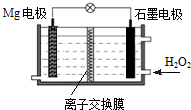 Mg-H2O2电池可用于无人驾驶的潜航器.该电池以海水为电解质溶液,示意图如图.下列说法正确的是( )
Mg-H2O2电池可用于无人驾驶的潜航器.该电池以海水为电解质溶液,示意图如图.下列说法正确的是( )| A. | Mg电极是该电池的正极 | B. | H2O2在石墨电极上发生氧化反应 | ||
| C. | 该电池的总反应为:Mg+H2O2═Mg(OH)2 | D. | 溶液中Cl-向正极移动 |
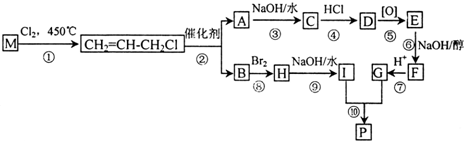
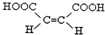 .
.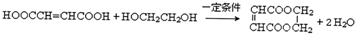 .
.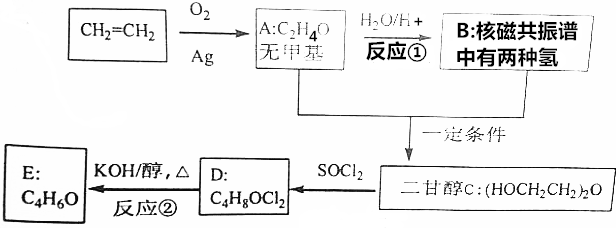
 DClCH2CH2OCH2CH2Cl;
DClCH2CH2OCH2CH2Cl;