题目内容
16.甲醇是重要的化工原料,又可做燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,主要反应如下:①CO(g)+2H2(g)?CH3OH(g)△H1
②CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H2=-58kJ/mol
③CO2(g)+H2(g)?CO(g)+H2O(g)△H3
已知反应①中的相关的化学键键能数据如下:
| 化学键 | H-H | C-O | C≡O (CO中的化学键) | H-O | C-H |
| E/(kJ/mol) | 436 | 343 | 1076 | 465 | 413 |
①△H3=+41kJ/mol.
②25℃,101kPa条件下,测得16g甲醇完全燃烧释放出Q kJ的热量,请写出表示甲醇燃烧热的热化学方程式CH3OH(l)+$\frac{3}{2}$O2(g)=CO2+2H2O△H=-2QkJ/mol.
分析 ①反应热=反应物总键能-生成物总键能;根据盖斯定律:反应②-反应③=反应①,反应热也进行相应的计算;
②液态甲醇完全燃烧生成二氧化碳气体和液态水,依据25℃,101kPa条件下,测得16g甲醇完全燃烧释放出Q kJ的热量,计算32g甲醇完全燃烧生成二氧化碳气体和液态水放出的热量,据此书写热化学方程式.
解答 解:①反应热=反应物总键能-生成物总键能,故△H1=1076kJ.mol-1+2×436kJ.mol-1-(3×413+343+465)kJ.mol-1=-99kJ.mol-1;
根据盖斯定律:反应②-反应①=反应③,故△H3=△H2-△H1=-58kJ.mol-1-(-99kJ.mol-1)=+41kJ.mol-1,
故答案为:+41;
②液态甲醇完全燃烧生成二氧化碳气体和液态水,反应方程式:CH3OH(l)+$\frac{3}{2}$ O2(g)=CO2(g)+2H2O
(l),依据25℃,101kPa条件下,测得16g甲醇完全燃烧释放出Q kJ的热量,则32g甲醇完全燃烧生成二氧化碳气体和液态水放出的热量为2QKJ,所以反应的热化学方程式:CH3OH(l)+$\frac{3}{2}$ O2(g)=CO2+2H2O△H=-2QkJ/mol;
故答案为:CH3OH(l)+$\frac{3}{2}$ O2(g)=CO2+2H2O△H=-2QkJ/mol.
点评 本题考查热化学方程式书写,反应热有关计算,明确反应热=反应物总键能-生成物总键能,盖斯定律计算反应热的方法,熟悉热化学方程式书写注意事项是解题关键,侧重考查学生分析计算能力,需要学生具备扎实的基础,难度中等.

练习册系列答案
相关题目
1.下列说法正确的是( )
| A. | 在测定中和热的实验中,为了准确测定反应混合溶液的温度,实验中温度计水银球应与小烧杯底部接触 | |
| B. | 酸碱中和滴定实验中,锥形瓶要用待装液预先润洗 | |
| C. | 在测定中和热的实验中,用0.5mol•L-1NaOH溶液分别与0.5 mol•L-1的盐酸、醋酸溶液反应,如所取的溶液体积相等,则测得的中和热数值相同 | |
| D. | 测溶液PH值时,PH试纸不能润湿 |
2.在浓度均为3mol/L的盐酸和硫酸各100mL溶液中,分别加入等质量的铁粉,充分反应后生成气体质量之比为3:4.则加入铁粉的质量是( )
| A. | 1.8 g | B. | 11.2 g | C. | 5.6 g | D. | 8.4 g |
1.在含有Ag+的酸性溶液中,以铁铵矾NH4Fe(SO4)2作指示剂,用KSCN的标准溶液滴定Ag+.
已知:AgSCN(白色s)?Ag++SCN-,Ksp=1.0×10-12
Fe3++SCN-?FeSCN2+(红色),K=138,下列说法不正确的是( )
已知:AgSCN(白色s)?Ag++SCN-,Ksp=1.0×10-12
Fe3++SCN-?FeSCN2+(红色),K=138,下列说法不正确的是( )
| A. | 边滴定,边摇动溶液,溶液中首先析出AgSCN白色沉淀 | |
| B. | 当Ag+定量沉淀后,少许过量的SCN-与Fe3+生成红色配合物,即为终点 | |
| C. | 上述实验采用相同指示剂,可用KCl标准溶液代替KSCN的标准溶液滴定Ag+ | |
| D. | 滴定时,必须控制溶液一定的酸性,防止Fe3+水解,影响终点的观察 |
5.T℃时,将A和B各0.32mol充入恒容密闭容器中,发生反应:A(g)+B(g)?2C(g)△H=-a kJ•mol-1(a>0),反应过程中测定的数据如表,下列说法正确的是( )
| t/min | 0 | 2 | 4 | 7 | 9 |
| n(B)/mol | 0.32 | 0.24 | 0.22 | 0.20 | 0.20 |
| A. | 若起始时向容器中充入0.64 mol C,则达平衡时吸收的热量为0.12a kJ | |
| B. | 恒温,如果压缩容器体积,B的浓度和体积分数均不变 | |
| C. | 若起始时向容器中充入 0.64 mol A 和 0.64 mol B,则达平衡时 n(C)<0.48 mol | |
| D. | 恒温、恒容,向平衡体系中再充入0.32 mol A,再次平衡时,B的转化率增大 |
6.已知某物质的物质的量,下列物理量中一定能够计算出值的是( )
| A. | 体积 | B. | 质量 | C. | 密度 | D. | 粒子数 |
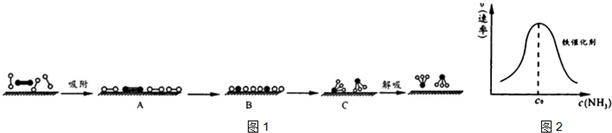
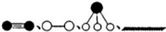 分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用图1表示:
分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用图1表示: