题目内容
1.某研究性学习小组学习了工业“侯氏制碱法”的原理后:【提出问题】能否在实验室模拟“侯氏制碱法”中制取NaHCO3的过程呢?
【实验原理】写出候氏制碱法反应的化学方程式NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl.
【实验验证】如图是该学习小组进行模拟实验时所用到的部分主要装置.回答下列问题:
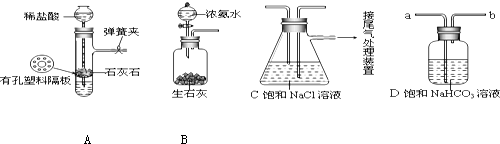
(1)检验A装置气密性的方法是:塞紧带长颈漏斗的橡胶塞,夹紧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于试管内的水面,停止加水后,若长颈漏斗中注入水,漏斗中与试管中的液(水)面差保持不再变化或漏斗中的液(水)面不再下降,说明装置不漏气.
(2)D是连接在装置A与装置C之间的气体净化装置,D的作用是除去HCl气体.
(3)实验时先向饱和NaCl溶液中通入气体的先后顺序先向饱和NaCl溶液中通入较多的NH3,再通入足量的CO2.
(4)用过滤的方法将生成的NaHCO3晶体从混合物中分离出来.如果要制得纯碱,还需发生的反应是(写出反应的化学方程式):2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑.
【得出结论】利用“侯氏制碱法”在实验室可以制取NaHCO3.
分析 (1)注入一定量的水后,试管内气体被压缩管内压强增大,使得出现液面差;液面差保持不变时,说明装置不漏气;
(2)为使气体通过溶液,气体从a通入溶液,混在气体中的HCl与溶液中的碳酸氢钠反应而被吸收;换做碳酸钠溶液,二氧化碳气体被碳酸钠溶液吸收;
(3)实验时先向饱和NaCl溶液中通入气体的先后顺序是先向饱和NaCl溶液中通入较多的氨气,再通入足量的二氧化碳;
(4)还需发生的反应是2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑.
解答 解:候氏制碱法是用二氧化碳通入氨化的饱和氯化钠溶液中反应生成碳酸氢钠晶体,反应的化学方程式:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl;
故答案为:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl
(1)随水的注入管内加压增大,漏斗内液体不能再流入试管,使长颈漏斗与管内液面出现液面差,并且液面差保持不变,说明装置气密性良好;
故答案为:长颈漏斗中注入水,漏斗中与试管中的液(水)面差保持不再变化或漏斗中的液(水)面不再下降;
(2)装置D内盛放的碳酸氢钠溶液能与混在气体中的HCl发生反应生成氯化钠、水和二氧化碳,从而除去混在气体中的HCl;
故答案为:HCl;
(3)实验时先向饱和NaCl溶液中通入气体的先后顺序是先向饱和NaCl溶液中通入较多的NH3,再通入足量的CO2;
故答案为:先向饱和NaCl溶液中通入较多的NH3,再通入足量的CO2;
(4)如果制得纯碱需要对碳酸氢钠固体加热分解得到,反应化学方程式为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑;
故答案为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑
点评 本题考查了利用工业制碱原理,设计实验室制取碳酸钠的实验方案分析判断,根据装置中的药品的性质及装置的连接方式,是准确判断或理解装置作用的一种有效方法.

 备战中考寒假系列答案
备战中考寒假系列答案| A. | N层不含电子 | B. | 该元素是硫元素 | ||
| C. | L层一定有8个电子 | D. | 原子最外层电子数为4 |
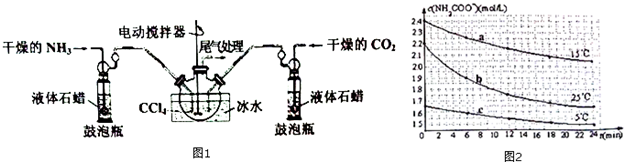
请回答下列问题:
(1)制备NH2COONH4的反应在一定条件下能自发进行,该反应的△H<0(填“>”“=”或“<”);要提高NH2COONH4的产率可采取的措施为增大压强、适当降低温度.
(2)装置中盛液体石蜡的鼓泡瓶作用是通过观察气泡,使气体流速均匀,调节NH3与CO2通入比例.
(3)一定条件下,在恒容密闭容器中通入体积比为2:1的NH3和CO2制备NH2COONH4固体.
①下列能说明反应达到平衡状态的是bd.
a、NH3和CO2物质的量之比为2:1
b.密闭容器中混合气体的密度不变
c、反应的焓变不变
d.固体的质量不在发生变化
②实验测得不同温度下达到平衡时气体的总浓度如表
| 温度(℃) | 20.0 | 30.0 | 40.0 |
| 平衡时气体总浓度 (×10-3mol•L-1) | 3.4 | 4.8 | 6.8 |
(4)己知:NH2C00NH4+2H20?NH4HCO3+NH3•H2O.分别用三份不份不同初始浓度的NH2COONH4溶液测定不同温度下的水解反应速率,得到c(NH2COO-)随时间变化趋势如图2所示.
①15℃时,0~6min内NH2COONH4水解反应的平均速率为0.05mol/(L•min).
②对比图中曲线a、b、c可知,水解反应速率最大的是b.
| A. | 为处理锅炉水垢中的CaSO4,可先用饱和Na2CO3溶液浸泡,再加入盐酸溶解 | |
| B. | 实验室制氢气,为了加快反应速率,可向稀H2SO4中滴加少量 Cu(NO3)2溶液 | |
| C. | N2(g)+3H2(g)?2NH3(g)△H<0,降低温度时:v(正)增大,v (逆)减小,平衡时氢气转化率增大 | |
| D. | 吸热反应“TiO2(s)+2Cl2(g)═TiCl4(g)+O2(g)”在一定条件下可自发进行,则该反 应的△S<0 |
| A. | 除去O2中混有的N2:选用灼热的铜网 | |
| B. | 提取碘水中的碘单质:选用有机试剂苯 | |
| C. | 除去CO2中混有的CO:选用适量澄清石灰水 | |
| D. | 除去Mg粉中混有的MgO:选用过量稀盐酸 |
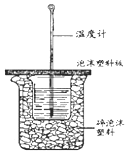 50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:
50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题: