题目内容
7. 常温下,将浓度为0.02mol•L-1的MOH溶液逐滴滴入100mL 0.01mol•L-1HA溶液中,溶液pH随MOH溶液体积变化如图所示,若忽略溶液混合时体积的变化,下列叙述正确的是( )
常温下,将浓度为0.02mol•L-1的MOH溶液逐滴滴入100mL 0.01mol•L-1HA溶液中,溶液pH随MOH溶液体积变化如图所示,若忽略溶液混合时体积的变化,下列叙述正确的是( )| A. | 忽略温度影响,滴入MOH溶液过程中,水的电离程度不变 | |
| B. | HA为弱酸,MOH为强碱 | |
| C. | N点MOH过量,故溶液中c(M+)>c(A-) | |
| D. | K点的c(MOH)+c(M+)=0.01 mol•L-1 |
分析 0.01mol•L-1 HA溶液中pH=2,则HA是强酸,N点时溶液呈中性,MOH的物质的量大于HA的物质的量,说明MOH是弱碱,酸或碱性溶液抑制水电离,含有弱根离子的盐促进水电离,根据物料守恒计算K点c(MOH)和c(M+)的和即可.
解答 解:A、忽略温度影响,滴入MOH溶液过程中,水的电离程度受到抑制,故A错误;
B、0.01mol•L-1 HA溶液中pH=2,则HA是强酸,N点时溶液呈中性,MOH的物质的量大于HA的物质的量,说明MOH是弱碱,故B错误;
C、N点时溶液呈中性,MOH的物质的量大于HA的物质的量,说明MOH是弱碱,K点溶液为MA和MOH,溶液呈碱性,电离大于水解,溶液中c(A-)<c(M+),故C正确;
D、在K点时混合溶液体积是碱溶液的2倍,根据物料守恒结合溶液体积变化知,c(MOH)+c(M+)=0.01mol•L-1,根据电荷守恒得c(M+)+c(H+)=c(OH-)+c(A-),c(MOH)+c(OH-)-c(H+)=c(M+)-c(A-)+c(MOH)=0.01mol•L-1-0.005mol•L-1=0.005mol•L-1,故D错误;
故选C.
点评 本题考查了酸碱混合时的定性判断,注意根据酸溶液的pH和酸的浓度确定酸的强弱,为易错点,题目难度中等.

练习册系列答案
相关题目
17.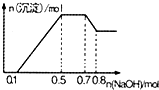 某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、Cl-中的几种,若向溶液中加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入的物质的量之间的关系如图所示,下列说法正确的是( )
某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、Cl-中的几种,若向溶液中加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入的物质的量之间的关系如图所示,下列说法正确的是( )
 某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、Cl-中的几种,若向溶液中加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入的物质的量之间的关系如图所示,下列说法正确的是( )
某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、Cl-中的几种,若向溶液中加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入的物质的量之间的关系如图所示,下列说法正确的是( )| A. | 溶液中的阳离子只有H+、Mg2+、Al3+ | |
| B. | 无法确定溶液中是否含有CO32-、SO42-和Cl- | |
| C. | 溶液中n(NH4+)=0.2mol | |
| D. | n(H+):n(Al3+):n(Mg2+)=1:1:1 |
18.在两个密闭容器中,分别充有质量相等的甲、乙两种气体,它们的温度和密度均相同.试根据甲、乙的摩尔质量(M)的关系,判断下列说法中正确的是( )
| A. | 若M(甲)>M(乙),则分子数:甲>乙 | B. | 若M(甲)<M(乙),则气体摩尔体积:甲>乙 | ||
| C. | 若M(甲)<M(乙),则气体的压强:甲>乙 | D. | 若M(甲)>M(乙),则气体体积:甲<乙 |
15.下列反应属于氧化还原反应的是( )
| A. | HCl+NaOH═NaCl+H2O | B. | SO3+H2O═H2SO4 | ||
| C. | 2Na+Cl2$\frac{\underline{\;点燃\;}}{\;}$2NaCl | D. | CaCO3$\frac{\underline{\;高温\;}}{\;}$ CaO+CO2↑ |
2.对于下列事实的解释错误的是( )
| A. | 浓硫酸使胆矾晶体的蓝色褪去,说明浓硫酸具有吸水性 | |
| B. | 豆科植物根部的根瘤菌可以将空气中的氮由游离态转为化合态是氮的固定 | |
| C. | 常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸不反应 | |
| D. | 氨水可使酚酞试剂变为红色,说明氨水显碱性 |
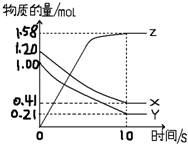 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示: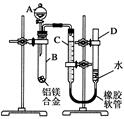 某学习小组用如图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量.
某学习小组用如图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量.