题目内容
8.工业常用燃料与水蒸气反应制各H2和CO,再用H2和CO合成甲醇.(1)制取H2和CO通常采用:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.4kJ•mol-1,下列判断正确的是ad.
A.该反应的反应物总能量小于生成物总能量
B.标准状况下,上述反应生成IL H2气体时吸收131.4kJ的热量
C.若CO(g)+H2(g)?C(s)+H2O(l)△H=-QkJ•mol-1,则Q<131.4
D.若C(s)+CO2(g)?2CO(g)△H1;CO(g)+H2O(g)?H2(g)+CO2(g)△H2 则:△H1+△H2=+131.4kJ•mol-1
(2)甲烷与水蒸气反应也可以生成H2和CO.该反应为:CH4(g)+H2O(g)?CO(g)+3H2(g)
己知在某温度下2L的密闭绝热容器中充入2.00mol甲烷和1.00mol水蒸气,测得的数据如下表:
| 不同时间各物质的物质的量/mol | ||||
| 0min | 2min | 4min | 6min | |
| CH4 | 2.00 | 1.76 | 1.60 | n2 |
| H2 | 0.00 | 0.72 | n1 | 1.20 |
①0min~2min内H2的平均反应速率为0.18mol•L-1•min-1.
②达平衡时,CH4的转化率为20%.在上述平衡体系中再充入2.00mol甲烷和1.00mol水蒸气,达到新平衡时H2的体积分数与原平衡相比变小(填“变大”、“变小”或“不变”),可判断该反应达到新平衡状态的标志有ad(填字母)
A.CO的含量保持不变 B.容器中c(CH4)与c(CO)相等
C.容器中混合气体的密度保持不变 D.3v正(CH4)=v逆(H2)
( 3 )合成甲醇工厂的酸性废水中含有甲醇(CH3OH),常用向废液中加入硫酸钴,再用微生物电池电解,电解时Co2+被氧化成Co3+,Co3+把水中的甲醇氧化成CO2,达到除去甲醇的目的.工作原理如图(c为隔膜,甲醇不能通过,其它离子和水可以自由通过).
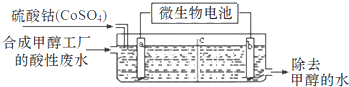
①a电极的名称为阳极.
②写出除去甲醇的离子方程式6Co3++CH3OH+H2O=6Co2++CO2+6H+.
分析 (1)a、反应是吸热反应,依据能量守恒分析判断,生成物能量总和大于反应物能量总和;
b、标准状况下,上述反应生成1mol H2气体时吸收131.4 kJ的热量;
c、若CO(g)+H2(g)?C(s)+H2O(1)△H=-QkJ•mol-1,则Q=131.4;
d、根据盖斯定律,若C(s)+CO2(g)?2CO(g)△H1;CO(g)+H2O(g)?H2(g)+CO2(g)△H2 则:△H1+△H2=+131.4kJ•mol-1;
(2)①根据反应速率=$\frac{△c}{△t}$计算;
②4min时,参加反应的甲烷为2mol-1.6mol=0.4mol,生成氢气为0.4mol×3=1.2mol,达到平衡,根据转化率=$\frac{已转化的量}{起始的量}$×100%计算;在上述平衡体系中再充入2.00mol甲烷和1.00mol 水蒸气,压强增大,平衡向逆反应方向移动,达到新平衡时H2的体积分数与原平衡相比变小;
a.CO的含量保持不变,反应达到平衡;
b.容器中c(CH4)与c(CO)相等,不一定平衡;
c.容器中混合气体的密度一直不变,不是平衡状态的标志;
d.3ν正(CH4)=ν逆(H2),反应达到平衡;
(3)①电极a,Co2+被氧化成Co3+,发生氧化反应,为电解池的阳极;
②甲醇被氧化生成二氧化碳,Co3+被还原生成Co2+,溶液呈酸性,则生成物中含有氢离子,据此书写离子方程式.
解答 解:(1)a、反应是吸热反应,依据能量守恒分析判断,生成物能量总和大于反应物能量总和,故a正确;
b、标准状况下,上述反应生成1mol H2气体时吸收131.4 kJ的热量,故b错误;
c、若CO(g)+H2(g)?C(s)+H2O(1)△H=-QkJ•mol-1,则Q=131.4,故c错误;
d、根据盖斯定律,若C(s)+CO2(g)?2CO(g)△H1;CO(g)+H2O(g)?H2(g)+CO2(g)△H2 则:△H1+△H2=+131.4kJ•mol-1,故d正确;
故答案为:ad;
(2)①0min~2min 内H2的平均反应速率为$\frac{0.72mol}{2L×2min}$=0.18mol•L-1•min-1,
故答案为:0.18mol•L-1•min-1;
②4min时,参加反应的甲烷为2mol-1.6mol=0.4mol,生成氢气为0.4mol×3=1.2mol,达到平衡,此时甲烷的转化率为$\frac{0.4mol}{2mol}$×100%=20%;在上述平衡体系中再充入2.00mol甲烷和1.00mol 水蒸气,压强增大,平衡向逆反应方向移动,达到新平衡时H2的体积分数与原平衡相比变小;
a.CO的含量保持不变,反应达到平衡;
b.容器中c(CH4)与c(CO)相等,不一定平衡;
c.容器中混合气体的密度一直不变,不是平衡状态的标志;
d.3ν正(CH4)=ν逆(H2),反应达到平衡;
故答案为:20%;变小;ad;
(3)①电极a,Co2+被氧化成Co3+,发生氧化反应,为电解池的阳极,
故答案为:阳极;
②甲醇被氧化生成二氧化碳,Co3+被还原生成Co2+,溶液呈酸性,则生成物中含有氢离子,所以该反应离子方程式为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+,
故答案为:6Co3++CH3OH+H2O=6Co2++CO2+6H+.
点评 本题考查了化学反应焓变和能量变化特征分析,注意焓变表达的意义和可能反应不能进行彻底的分析判断,题目较简单.

 浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg $\frac{V}{{V}_{0}}$的变化如图所示,下列叙述错误的是( )
浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg $\frac{V}{{V}_{0}}$的变化如图所示,下列叙述错误的是( )| A. | MOH 的电离程度随lg $\frac{V}{{V}_{0}}$的增大而增大 | |
| B. | ROH 的电离程度:b点大于a点 | |
| C. | 若两溶液无限稀释,则它们的c(OH-)相等 | |
| D. | 当lg $\frac{V}{{V}_{0}}$=2 时,若两溶液同时升高温度,则$\frac{c({M}^{+})}{c({R}^{+})}$减小 |
| A. | HCl+NaOH═NaCl+H2O | B. | SO3+H2O═H2SO4 | ||
| C. | 2Na+Cl2$\frac{\underline{\;点燃\;}}{\;}$2NaCl | D. | CaCO3$\frac{\underline{\;高温\;}}{\;}$ CaO+CO2↑ |
①信州铅山县有苦泉,流以为涧.挹其水熬之,则成胆矾.烹胆矾则成铜;熬胆矾铁釜亦化为铜.水能为铜,物之变化,固不可测.
②取精铁煅之百余火,每煅称之,一煅一轻,至累煅二斤两不减,则纯钢也,虽百炼不轻.
上述科技史实没有涉及到的化学反应类型有( )
| A. | 化合反应 | B. | 分解反应 | C. | 置换反应 | D. | 复分解反应 |
| A. | 钠钾合金可用于中子反应堆作热交换剂 | |
| B. | 氯气本身有毒,因此不能用于药物合成 | |
| C. | 不用氧化镁电解熔融制镁的原因是氧化镁不导电 | |
| D. | 工业高炉炼铁过程中,加石灰石主要是为了制备还原剂 |
 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示: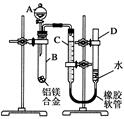 某学习小组用如图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量.
某学习小组用如图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量.
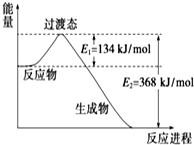 (1)如图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234KJ/mol.
(1)如图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234KJ/mol.