题目内容
14.下列关于某些物质(离子)的检验方法或结论正确的是( )| A. | 用丁达尔效应鉴别NaCl溶液和KCl溶液 | |
| B. | 向某溶液中加入BaCl2溶液出现白色沉淀,则该溶液中肯定有SO42- | |
| C. | 用KSCN溶液鉴别FeCl2溶液和Fe2(SO4)3溶液 | |
| D. | 用焰色反应可鉴别出NaCl、KCl和Na2SO4三种物质 |
分析 A.丁达尔效应是胶体的独有性质;
B.加入BaCl2溶液出现白色沉淀,可能生成AgCl沉淀;
C.三价铁离子遇到KSCN溶液会生成血红色溶液;
D.钠盐的焰色反应都呈黄色,用焰色反应检验K元素,应通过蓝色钴玻璃.
解答 解:A.丁达尔效应是胶体的独有性质,而溶液无此性质,利用丁达尔效应不能鉴别NaCl溶液和KCl溶液,故A错误;
B.加入BaCl2溶液出现白色沉淀,可能生成AgCl沉淀,检验溶液中是否含有SO42-,应加入硝酸钡溶液,故B错误;
C.亚铁离子和KSCN溶液不发生反应,铁离子遇到KSCN溶液生成血红色溶液,用KSCN溶液鉴别FeCl2溶液和Fe2(SO4)3溶液,故C正确;
D.用焰色反应检验K元素,应通过蓝色钴玻璃,并且用焰色反应无法鉴别NaCl和Na2SO4,故D错误.
故选C.
点评 本题考查物质的检验和鉴别,侧重于学生的分析和实验能力的考查,为高考常见题型,注意把握物质的性质的异同,为解答该题的关键,题目难度不大.

练习册系列答案
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案
相关题目
19.由CO2、H2和CO组成的混合气体在同温、同压下与氮气的密度相同,则该混合气体中CO2、H2和CO的体积比为( )
| A. | 19:8:13 | B. | 22:1:14 | C. | 13:9:29 | D. | 26:16:27 |
2.H、C、N、O、Na、S、Cl是常见的七种短周期元素.
(1)N位于元素周期表第二 周期第ⅤA 族,其基态原子核外有3个未成对电子;S的基态原子核外电子排布式为1s22s22p63s23p4.
(2)用“>”或“<’’填空:
(3)由上述元素中的任意两种元素组成的化合物中,既含极性键又含非极性键的物质有H2O2、N2H4、C2H2、C2H4、C2H6、C6H6等任选其一(任写一种物质的分子式).
(4)NH3可作低温溶剂,它易液化的原因是NH3分子间能形成分子间氢键,氢键的存在使得氨气分子间作用力显著增强,沸点显著升高,易液化.已知25℃、101KPa,NH3能在纯氧中燃烧,每转移1mol e-,放出akJ热量,写出该条件下NH3燃烧的热化学方程式4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-4a kJ/mol.
(5)通常情况下,N2O5为无色晶体,它与Na2O2能发生反应(类似于CO2与Na2O2能反应),写出反应的化学方程式,并用单线桥标出电子转移的方向和数目: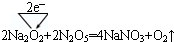 .
.
(1)N位于元素周期表第二 周期第ⅤA 族,其基态原子核外有3个未成对电子;S的基态原子核外电子排布式为1s22s22p63s23p4.
(2)用“>”或“<’’填空:
| 第一电离能 | 电负性 | 稳定性 | 酸性 |
| N>O | C<N | H2S<H2O | H2SO4<HClO4 |
(4)NH3可作低温溶剂,它易液化的原因是NH3分子间能形成分子间氢键,氢键的存在使得氨气分子间作用力显著增强,沸点显著升高,易液化.已知25℃、101KPa,NH3能在纯氧中燃烧,每转移1mol e-,放出akJ热量,写出该条件下NH3燃烧的热化学方程式4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-4a kJ/mol.
(5)通常情况下,N2O5为无色晶体,它与Na2O2能发生反应(类似于CO2与Na2O2能反应),写出反应的化学方程式,并用单线桥标出电子转移的方向和数目:
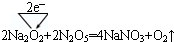 .
.
9.在核反应方程24He+714N→817O+X中,X代表的粒子是( )
| A. | 11H | B. | 12H | C. | -10e | D. | 01n |
6.质量为a g的铜丝放在空气中灼烧变黑,趁热放入下列物质中,铜丝变红,质量仍为a g的是( )
| A. | CH3COOH | B. | HNO3 | C. | CH3CH2OH | D. | NaOH |
3.对于下列反应,其中葡萄糖不能发生的是( )
| A. | 酯化 | B. | 氧化 | C. | 加成 | D. | 水解 |
4.漂白液的有效成分是( )
| A. | NaCl | B. | NaClO | C. | NaOH |
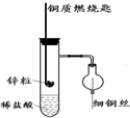 如图是实验室用氢气还原氧化铜实验的简易装置.其中的铜质燃烧匙可以在试管M中上下移动,实验时,先将细铜丝一端被弯成螺旋状,先在空气中加热变黑后再迅速伸入球型干燥管中.
如图是实验室用氢气还原氧化铜实验的简易装置.其中的铜质燃烧匙可以在试管M中上下移动,实验时,先将细铜丝一端被弯成螺旋状,先在空气中加热变黑后再迅速伸入球型干燥管中.