题目内容
9.取200mL 0.2mol/L的 KI溶液与一定量的酸性 KMnO4 溶液恰好反应,生成KIO3,则消耗 KMnO4的物质的量的是0.048mol.分析 该反应中I元素化合价由-1价变为+5价、Mn元素化合价由+7价变为+2价,根据转移电子守恒计算高锰酸钾的物质的量.
解答 解:n(KI)=0.2mol/L×0.2L=0.04mol,该反应中I元素化合价由-1价变为+5价、Mn元素化合价由+7价变为+2价,根据转移电子守恒得n( KMnO4)=$\frac{0.04mol×[5-(-1)]}{7-2}$=0.048mol,
故答案为:0.048.
点评 本题考查化学方程式的有关计算,为高频考点,侧重考查学生分析计算能力,明确元素化合价变化是解本题关键,注意转移电子守恒的正确运用,也可以根据方程式计算,题目难度不大.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案
相关题目
17.下列有关金属及其合金的说法不正确的是( )
| A. | 目前我国流通的硬币是由合金材料制造的 | |
| B. | 锡青铜的熔点比纯铜高 | |
| C. | 镁在空气中燃烧发出耀眼的白光,可用于制作照明弹 | |
| D. | 日用铝制品表面覆盖着氧化膜,对内部金属起保护作用 |
14.人们通常把拆开1mol某物质的化学键所吸收的能量看作该物质的化学键的键能,键能的大小可以衡量化学键的相对强弱.由图判断,下列说法错误的是( )
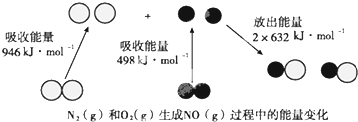

| A. | N≡N键的键能为946kJ•mol-1 | |
| B. | N2(g)+O2(g)═2NO(g)△H=+180kJ•mol-1 | |
| C. | 当有16gO2(g)参加反应时,该反应吸收90kJ热量 | |
| D. | 当有1mol电子发生转移时,该反应吸收90kJ热量 |
1.镁铝合金5.1g加入到100mL 6.0mol•L-1盐酸中,待固体完全溶解后,向溶液中继续逐滴滴入6.0mol•L-1的氢氧化钠溶液,当滴入VmL时沉淀质量达到最大值,继续滴入氢氧化钠至沉淀的量不再变化,将沉淀过滤、洗涤、低温烘干,称重得质量为5.8g.下列说法正确的是( )
| A. | 开始滴入NaOH溶液时立即产生白色沉淀 | |
| B. | 原固体混合物中镁的质量是1.2g | |
| C. | V=100mL | |
| D. | 若将5.1g该合金溶于足量的氢氧化钠溶液,在常温常压下放出3.36L气体 |
18.下列有关叙述正确的是( )
| A. | Cl2、SO2均能使品红溶液褪色,说明二者均有漂白性 | |
| B. | 元素周期表中第IA族全部是金属元素 | |
| C. | 盛有浓硫酸的烧杯敞口放置一段时间后,质量增加 | |
| D. | 硫在纯氧中的燃烧产物是三氧化硫 |
19.设NA为阿伏伽德罗常数,下列说法一定正确的是( )
| A. | 4g D2和足量O2反应可生成D2O 2NA个 | |
| B. | 98g H3PO4和H2SO4的混合物中含氢原子2.5NA个 | |
| C. | 6.02×1023个葡萄糖分子约含羟基6NA个 | |
| D. | 1molNa完全燃烧可转移电子NA个 |
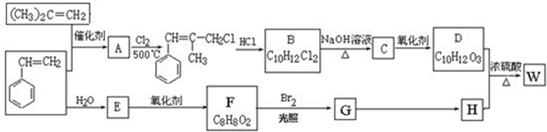

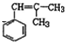 ;W的结构简式:
;W的结构简式: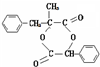 .
.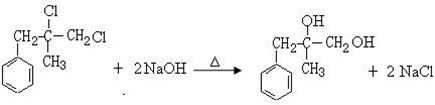 ;由D生成高分子化合物的方程式
;由D生成高分子化合物的方程式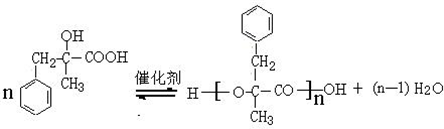 .
.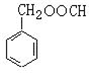 (写结构简式),其峰面积之比为1:2:2:2:1.
(写结构简式),其峰面积之比为1:2:2:2:1.