题目内容
能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
Ⅰ.已知在常温常压下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H═-1275.6KJ?mol-1
②2CO(g)+O2(g)═2CO2(g)△H═-566.0KJ?mol-1
③H2O(g)═H2O(l)△H═-44.0KJ?mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
Ⅱ.工业上合成甲醇的反应为:CO(g)+2H2(g)?CH3OH(g);△H
(1)该反应在300℃,5MPa条件下能自发进行,则△H 0,△S 0 (填“<,>或=”).
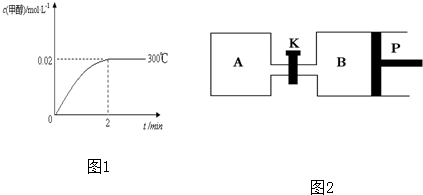
(2)在300℃,5MPa条件下,将0.20mol的 CO与0.58mol H2的混合气体充入2L密闭容器发生反应,反应过程中甲醇的物质的量浓度随时间的变化如图1所示.
①在0~2min内,以H2表示的平均反应速率为 mol?L-1?s-1.
②计算300℃时该反应的平衡常数K= .
③300℃时,将0.50mol CO、1.00mol H2和1.00mol CH3OH 充
入容积为2L的密闭容器中,此时反应将 .
A.向正方向移动 B.向逆方向移动
C.处于平衡状态 D.无法判断
④下列措施可增加甲醇产率的是
A.压缩容器体积 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大
D.再充入0.20mol CO和0.58mol H2
(3)若其它条件不变,使反应在500℃下进行,在图2中作出甲醇的物质的量浓度随时间的变化的示意图.
Ⅲ.甲醇可以与水蒸气反应生成氢气,反应方程式如下:
CH3OH(g)+H2O(g)???CO2(g)+3H2(g)△H>0.
(1)判断可逆反应达到平衡状态的依据是(填序号) .
A.v正(CH3OH)=v正(CO2)
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.CH3OH、H2O、CO2、H2的浓度都不再发生变化
(2)图2中P是可自由平行滑动的活塞,关闭K,在相同温度时,向A容器中充入1mol CH3OH(g)和2mol H2O(g),向B容器中充入1.2mol CH3OH(g)和2.4mol H2O(g),两容器分别发生上述反应.已知起始时容器A和B的体积均为a L.试回答:反应达到平衡时容器B的体积为1.5a L,容器B中CH3OH的转化率为 ,A、B两容器中H2O(g)的体积百分含量的大小关系为B A(填“>”“<”或“=”).
Ⅰ.已知在常温常压下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H═-1275.6KJ?mol-1
②2CO(g)+O2(g)═2CO2(g)△H═-566.0KJ?mol-1
③H2O(g)═H2O(l)△H═-44.0KJ?mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
Ⅱ.工业上合成甲醇的反应为:CO(g)+2H2(g)?CH3OH(g);△H
(1)该反应在300℃,5MPa条件下能自发进行,则△H
(2)在300℃,5MPa条件下,将0.20mol的 CO与0.58mol H2的混合气体充入2L密闭容器发生反应,反应过程中甲醇的物质的量浓度随时间的变化如图1所示.
①在0~2min内,以H2表示的平均反应速率为
②计算300℃时该反应的平衡常数K=
③300℃时,将0.50mol CO、1.00mol H2和1.00mol CH3OH 充
入容积为2L的密闭容器中,此时反应将
A.向正方向移动 B.向逆方向移动
C.处于平衡状态 D.无法判断
④下列措施可增加甲醇产率的是
A.压缩容器体积 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大
D.再充入0.20mol CO和0.58mol H2
(3)若其它条件不变,使反应在500℃下进行,在图2中作出甲醇的物质的量浓度随时间的变化的示意图.
Ⅲ.甲醇可以与水蒸气反应生成氢气,反应方程式如下:
CH3OH(g)+H2O(g)???CO2(g)+3H2(g)△H>0.
(1)判断可逆反应达到平衡状态的依据是(填序号)
A.v正(CH3OH)=v正(CO2)
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.CH3OH、H2O、CO2、H2的浓度都不再发生变化
(2)图2中P是可自由平行滑动的活塞,关闭K,在相同温度时,向A容器中充入1mol CH3OH(g)和2mol H2O(g),向B容器中充入1.2mol CH3OH(g)和2.4mol H2O(g),两容器分别发生上述反应.已知起始时容器A和B的体积均为a L.试回答:反应达到平衡时容器B的体积为1.5a L,容器B中CH3OH的转化率为

考点:热化学方程式,化学平衡的影响因素,化学平衡状态的判断,化学平衡的计算
专题:基本概念与基本理论
分析:Ⅰ、依据热化学方程式和盖斯定律 计算所得热化学方程式;
Ⅱ、(1)当△H-T△S<0时,反应自发进行,结合方程式分析即可;
(2)①据图分析出△c和△t即可求出;
②利用三段式法解答;
③据该温度下的K和Qc比较,当K>Qc时平衡正向移动,K<Qc时平衡逆向移动;
④结合影响平衡移动的因素,使平衡正向移动即可;
(3)结合影响反应速率和影响平衡移动的因素解答.
Ⅲ、(1)化学平衡的标志是正逆反应速率相同,各组分浓度保持不变分析选项;
(2)依据恒温恒容、恒温恒压容器变化,结合反应平衡特征分析判断,压强变化和物质的量变化成正比.
Ⅱ、(1)当△H-T△S<0时,反应自发进行,结合方程式分析即可;
(2)①据图分析出△c和△t即可求出;
②利用三段式法解答;
③据该温度下的K和Qc比较,当K>Qc时平衡正向移动,K<Qc时平衡逆向移动;
④结合影响平衡移动的因素,使平衡正向移动即可;
(3)结合影响反应速率和影响平衡移动的因素解答.
Ⅲ、(1)化学平衡的标志是正逆反应速率相同,各组分浓度保持不变分析选项;
(2)依据恒温恒容、恒温恒压容器变化,结合反应平衡特征分析判断,压强变化和物质的量变化成正比.
解答:
解:Ⅰ、(1)①H2O(g)=H2O(l)△H1=-44.0kJ/mol
②2CO (g)+O2(g)=2CO2(g)△H2=-566.0kJ/mol
③2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H3=-1275.6kJ/mol;
由盖斯定律可知③-②+4×①得到甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8KJ/mol;
故答案为:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8KJ/mol;
Ⅱ、(1)该反应的反应物有3mol气体,生成物有1mol气体,所以△S<0,反应自发进行△H-T△S<0,故△H必须小于0,故答案为:<;<;
(2)①2min时,甲醇浓度变化0.02mol/L,则氢气浓度变化为0.04mol/L,v(H2)=
=
=0.02mol/(L?min)-1
故答案为:0.02;
②CO(g)+2H2(g)?CH3OH(g)
加入的(mol/L) 0.10 0.29 0
反应的(mol/L) 0.02 0.04 0.02
平衡后(mol/L) 0.08 0.25 0.02
K=
=
=4(mol/L)-2
故答案为:4(mol/L)-2;
③Qc=K=
=
=8>K=4,所以平衡逆向移动,故答案为:B;
④A、对于反应CO(g)+2H2(g)?CH3OH(g),反应物气体体积大于生成物,压缩容器体积 时,压强增大,平衡正向移动,可增加甲醇产率,故A正确;
B、分离出甲醇,平衡正向移动可增加甲醇产率,故B正确;
C、充入He,不影响各气体的分压,平衡不移动,不能增加甲醇产率,故C错误;
D、体积不变,再充入反应物气体,平衡正向移动,可增加甲醇产率,故D正确.
故选:ABD;
(3)温度升高,反应速率加快,达到平衡时间短.正反应放热,升温时平衡逆向移动,平衡时甲醇浓度比300℃低,可得下图: ,
,
故答案为: ;
;
Ⅲ、(1)可逆反应达到平衡状态的依据是正逆反应速率相同,
A、v正(CH3OH)=v正(CO2)是反应速率之比等于化学方程式计量数之比,不能说你反应达到平衡,故A不符合;
B、反应前后气体质量不变,容器体积不变,反应过程中密度不变,混合气体的密度不变不能说明反应达到平衡,故B不符合;
C、反应前后气体物质的量增大,质量守恒,混合气体的平均相对分子质量不变,说明反应达到平衡状态,故C符合;
D、CH3OH、H2O、CO2、H2的浓度都不再发生变化是平衡标志,故D符合;
故答案为:CD;
(2)B容器的体积变为原来的1.5倍,增加的气体的物质的量为3.6 mol×0.5=1.8 mol,依据化学方程式可知增加2mol,反应甲醇1mol,则反应的甲醇的物质的量为0.9 mol,CH3OH的转化率=
×100%=75%.A是恒容反应容器,B是恒压反应容器.B容器充入1.2molCH3OH(g) 和2.4molH2O(g)与B容器充入1molCH2OH(g)和2molH2O(g),是等效平衡.反应方程式中生成物气体增多,反应时A容器压强比B容器大,所以A中平衡时相当于B平衡后的加压,加压平衡向逆反应方向移动,A容器中H2O百分含量增多,填B“<A”;
故答案为:75%;<.
②2CO (g)+O2(g)=2CO2(g)△H2=-566.0kJ/mol
③2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H3=-1275.6kJ/mol;
由盖斯定律可知③-②+4×①得到甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8KJ/mol;
故答案为:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8KJ/mol;
Ⅱ、(1)该反应的反应物有3mol气体,生成物有1mol气体,所以△S<0,反应自发进行△H-T△S<0,故△H必须小于0,故答案为:<;<;
(2)①2min时,甲醇浓度变化0.02mol/L,则氢气浓度变化为0.04mol/L,v(H2)=
| △c(H2) |
| △t |
| 0.04mol/L |
| 2min |
故答案为:0.02;
②CO(g)+2H2(g)?CH3OH(g)
加入的(mol/L) 0.10 0.29 0
反应的(mol/L) 0.02 0.04 0.02
平衡后(mol/L) 0.08 0.25 0.02
K=
| c(CH3OH) |
| c(CO)c2(H2) |
| 0.02mol/L |
| 0.08mol/L×(0.25mol/L)2 |
故答案为:4(mol/L)-2;
③Qc=K=
| c(CH3OH) |
| c(CO)c2(H2) |
| 0.50 |
| 0.25×0.502 |
④A、对于反应CO(g)+2H2(g)?CH3OH(g),反应物气体体积大于生成物,压缩容器体积 时,压强增大,平衡正向移动,可增加甲醇产率,故A正确;
B、分离出甲醇,平衡正向移动可增加甲醇产率,故B正确;
C、充入He,不影响各气体的分压,平衡不移动,不能增加甲醇产率,故C错误;
D、体积不变,再充入反应物气体,平衡正向移动,可增加甲醇产率,故D正确.
故选:ABD;
(3)温度升高,反应速率加快,达到平衡时间短.正反应放热,升温时平衡逆向移动,平衡时甲醇浓度比300℃低,可得下图:
 ,
,故答案为:
 ;
;Ⅲ、(1)可逆反应达到平衡状态的依据是正逆反应速率相同,
A、v正(CH3OH)=v正(CO2)是反应速率之比等于化学方程式计量数之比,不能说你反应达到平衡,故A不符合;
B、反应前后气体质量不变,容器体积不变,反应过程中密度不变,混合气体的密度不变不能说明反应达到平衡,故B不符合;
C、反应前后气体物质的量增大,质量守恒,混合气体的平均相对分子质量不变,说明反应达到平衡状态,故C符合;
D、CH3OH、H2O、CO2、H2的浓度都不再发生变化是平衡标志,故D符合;
故答案为:CD;
(2)B容器的体积变为原来的1.5倍,增加的气体的物质的量为3.6 mol×0.5=1.8 mol,依据化学方程式可知增加2mol,反应甲醇1mol,则反应的甲醇的物质的量为0.9 mol,CH3OH的转化率=
| 0.9mol |
| 1.2mol |
故答案为:75%;<.
点评:本题考查了化学平衡三段式计算,平衡标志的分析判断,恒温恒容容器,恒温恒压容器的分析判断是解题关键,气体压强之比和物质的量之比成正比例,题目难度较大.

练习册系列答案
相关题目
一定量的氢气在一定条件下完全燃烧生成气态水,放出热量值为Q1,等量的H2在同样条件下完全燃烧生成液态水,放出热量值为Q2,则Q1与Q2的关系为( )
| A、Q1>Q2 |
| B、Q1=Q2 |
| C、Q1<Q2 |
| D、无法确定 |
VCD光盘的记录材料有很多种,它们都可以在激光照射下发生化学的或物理的性能改变而记录、储存信号.碲的某种化合物是常用的VCD光盘记录材料之一,对碲元素及其化合物的下列认识,错误的是( )
| A、Te元素位于周期表中第六周期第ⅥA族 |
| B、H2TeO4的酸性比H2SO4弱 |
| C、H2Te没有HI稳定 |
| D、单质碲在常温下是固体 |
 向20mL AlCl3溶液中滴入2mol?L-1 NaOH溶液时,沉淀质量与所滴加NaOH溶液体积(mL)关系如图所示:
向20mL AlCl3溶液中滴入2mol?L-1 NaOH溶液时,沉淀质量与所滴加NaOH溶液体积(mL)关系如图所示:
 Ⅰ、对于反应CO(g)+H2O(g)?H2(g)+CO2(g)
Ⅰ、对于反应CO(g)+H2O(g)?H2(g)+CO2(g)