题目内容
2006年8月末,甘肃省徽县水阳乡有373名儿童被诊断为重度铅中毒.国家环保总局派出专家调查认为,水阳乡的一家铅锭冶炼厂是“罪魁祸首”.该铅锭冶炼厂主要采用火法冶炼铅,其主要过程是先在空气中煅烧方铅矿(主要成分为PbS)制氧化铅(PbO),再用CO还原氧化铅,致使排出的烟气造成周边土地已全部被铅污染,雨水酸度增加形成酸雨.
(1)写出火法炼铅有关的化学方程式 ; .
(2)为了防止酸雨的形成,将排出的烟气回收利用制硫酸.若煅烧50t含47.8%PbS的方铅矿,在烟气回收过程中硫的损失率为2%,计算可制得98%的浓硫酸的质量.试写出计算过程.
(1)写出火法炼铅有关的化学方程式
(2)为了防止酸雨的形成,将排出的烟气回收利用制硫酸.若煅烧50t含47.8%PbS的方铅矿,在烟气回收过程中硫的损失率为2%,计算可制得98%的浓硫酸的质量.试写出计算过程.
考点:金属冶炼的一般原理,化学方程式的有关计算
专题:计算题
分析:(1)依据制备原理,煅烧方铅矿制氧化铅(PbO)和二氧化硫,再用CO还原氧化铅为铅和二氧化碳,依据原子守恒配平书写化学方程式;
(2)根据硫元素守恒,利用关系式列式计算,反应的关系式为:PbS~H2SO4.
(2)根据硫元素守恒,利用关系式列式计算,反应的关系式为:PbS~H2SO4.
解答:
解:(1)煅烧方铅矿制氧化铅(PbO)和二氧化硫,反应的化学方程式为:2PbS+3O2
2PbO+2SO2,再用CO还原氧化铅为铅和二氧化碳,反应的化学方程式为:PbO+CO
Pb+CO2,
故答案为:2PbS+3O2
2PbO+2SO2;PbO+CO
Pb+CO2;
(2)设可制得98%的浓硫酸的质量为x,
PbS~H2SO4
239t 98t
50t×47.8%×(1-2%) xt×98%
解之得:x=980t,
答:制得98%的浓硫酸的质量为980t.
| ||
| ||
故答案为:2PbS+3O2
| ||
| ||
(2)设可制得98%的浓硫酸的质量为x,
PbS~H2SO4
239t 98t
50t×47.8%×(1-2%) xt×98%
解之得:x=980t,
答:制得98%的浓硫酸的质量为980t.
点评:本题考查了铅及其化合物性质的分析应用,主要是化学方程式书写和化学方程式的有关计算,注意题干信息的分析应用,掌握基础和信息应用是关键,注意反应的关系式,从硫元素守恒的角度解答,题目难度中等.

练习册系列答案
相关题目
下列反应中属于取代反应的是( )
| A、苯与浓硝酸在浓硫酸作用下共热至50~60℃ |
| B、乙烯通入溴水中 |
| C、苯与氢气在催化剂作用下反应制得环己烷 |
| D、苯与溴水混合后,溴水层褪色 |
物质的量单位--摩尔的基准是( )
| A、6.02×1023这个常数 |
| B、0.012kg的碳 |
| C、1摩尔任何物质所含的微粒数 |
| D、0.012kg的12C所含有的原子数 |
在密闭容器中盛有H2、O2、Cl2的混合气体,通过电火花点燃后,容器内三种气体恰好完全反应,冷却到室温得质量分数为33.6%的盐酸,则容器中H2、O2、Cl2的体积比是( )
| A、9:4:1 |
| B、10:4:1 |
| C、5:4:1 |
| D、3:1:1 |
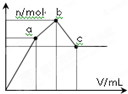 向100mL 0.1mol?L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol?L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.则下列说法中正确的是( )
向100mL 0.1mol?L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol?L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.则下列说法中正确的是( )| A、a点的溶液呈中性 |
| B、b点发生反应的离子方程式是:Al3++2SO42-+2Ba2++3OH-═Al(OH)3↓+2BaSO4↓ |
| C、c点加入Ba(OH)2溶液的体积为200mL |
| D、c点溶液呈碱性 |
为验证淀粉水解可生成还原性糖进行了下列实验,该实验中操作步骤的排列顺序正确的是( )
①取少量淀粉加水制成悬浊液 ②加热煮沸 ③加入新制的Cu(OH)2悬浊液④加几滴稀硫酸 ⑤再加热直至沸腾 ⑥加入碱液,中和直至溶液呈碱性.
①取少量淀粉加水制成悬浊液 ②加热煮沸 ③加入新制的Cu(OH)2悬浊液④加几滴稀硫酸 ⑤再加热直至沸腾 ⑥加入碱液,中和直至溶液呈碱性.
| A、①②④⑤③⑥ |
| B、①⑤③④⑥② |
| C、①④②⑥③⑤ |
| D、①④②③⑤⑥ |