题目内容
有X、Y、Z三种单质,X为金属单质,Y、Z为非金属单质,Y、Z通常情况下为气态,Y、Z一定条件下反应的产物溶于水可得无色溶液E,E能使紫色石蕊试液变红,X与E反应可生成Z和另一产物w,X、Y反应的产物F溶于水为棕黄色溶液,将Y通入w溶液也可得到F的溶液.
(1)Z的化学式是 .
A、O2 B、H2 C、Cl2 D、N2
(2)w的名称是 .
A、氯化铁 B、盐酸 C、氯化亚铁 D、铁
(3)棕黄色溶液F是
A、氯化铁溶液 B、氯化亚铁溶液 C、盐酸 D、氯水
(4)若往w溶液中滴入NaOH溶液,可产生沉淀,此沉淀在空气中发生变化,现象是
A、红色→灰绿色→红褐色 B、红褐色→白色→灰绿色 C、红色→红褐色→灰绿色 D、白色→灰绿色→红褐色.
(1)Z的化学式是
A、O2 B、H2 C、Cl2 D、N2
(2)w的名称是
A、氯化铁 B、盐酸 C、氯化亚铁 D、铁
(3)棕黄色溶液F是
A、氯化铁溶液 B、氯化亚铁溶液 C、盐酸 D、氯水
(4)若往w溶液中滴入NaOH溶液,可产生沉淀,此沉淀在空气中发生变化,现象是
A、红色→灰绿色→红褐色 B、红褐色→白色→灰绿色 C、红色→红褐色→灰绿色 D、白色→灰绿色→红褐色.
考点:无机物的推断
专题:推断题
分析:X为金属单质,Y、Z一定条件下反应的产物溶于水可得无色溶液E,E能使紫色石蕊试液变红,说明E的水溶液呈酸性,X与E反应可生成Z和另一产物w,则Z应为H2,X、Y反应的产物F溶于水为棕黄色溶液,应生成氯化铁,则Y为Cl2,X为Fe,w为氯化亚铁,以此解答该题.
解答:
解:X为金属单质,Y、Z一定条件下反应的产物溶于水可得无色溶液E,E能使紫色石蕊试液变红,说明E的水溶液呈酸性,X与E反应可生成Z和另一产物w,则Z应为H2,X、Y反应的产物F溶于水为棕黄色溶液,应生成氯化铁,则Y为Cl2,X为Fe,w为氯化亚铁,
(1)由以上分析可知Z为H2,故答案为:B;
(2)由以上分析可知w为氯化亚铁,故答案为:C;
(3)X、Y反应的产物F溶于水为棕黄色溶液,应生成氯化铁,故答案为:A;
(4)在氯化亚铁溶液中加入氢氧化钠,可生成白色絮状氢氧化亚铁沉淀,氢氧化亚铁不稳定,被空气氧气氧化生成氢氧化铜,可观察到白色絮状沉淀迅速变为灰绿色,最终变为红褐色,故答案为:D.
(1)由以上分析可知Z为H2,故答案为:B;
(2)由以上分析可知w为氯化亚铁,故答案为:C;
(3)X、Y反应的产物F溶于水为棕黄色溶液,应生成氯化铁,故答案为:A;
(4)在氯化亚铁溶液中加入氢氧化钠,可生成白色絮状氢氧化亚铁沉淀,氢氧化亚铁不稳定,被空气氧气氧化生成氢氧化铜,可观察到白色絮状沉淀迅速变为灰绿色,最终变为红褐色,故答案为:D.
点评:本题考查无机物的推断,为高频考点,侧重于学生的分析能力的考查,注意把握物质的性质及其转化,本题的突破口为物质的颜色变化,难度不大.

练习册系列答案
相关题目
下列含有非极性键的共价化合物是( )
| A、HCl |
| B、Na2O2 |
| C、CH3CH3(乙烷) |
| D、CH4 |
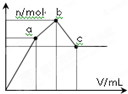 向100mL 0.1mol?L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol?L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.则下列说法中正确的是( )
向100mL 0.1mol?L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol?L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.则下列说法中正确的是( )| A、a点的溶液呈中性 |
| B、b点发生反应的离子方程式是:Al3++2SO42-+2Ba2++3OH-═Al(OH)3↓+2BaSO4↓ |
| C、c点加入Ba(OH)2溶液的体积为200mL |
| D、c点溶液呈碱性 |
在密闭容器中加入1molCO和1.5molH2O(气),在一定条件下达到平衡生成
molCO2,反应为CO+H2O(g)?CO2+H2,当其他条件不变,充入的水蒸气变为2mol,平衡时CO2的物质的量可能是( )
| 2 |
| 3 |
A、
| ||
| B、0.73mol | ||
| C、1mol | ||
D、
|
 ,试回答下列问题:
,试回答下列问题:
 利用生活中或实验室中常用的物品,根据氧化还原反应知识和电学知识,自己动手设计一个原电池.请填写下列空白:
利用生活中或实验室中常用的物品,根据氧化还原反应知识和电学知识,自己动手设计一个原电池.请填写下列空白: