题目内容
一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)?CH3OH(g)△H=Q;根据题意完成下列各题:
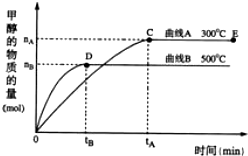
(1)反应达到平衡时,平衡常数表达式K= ,升高温度,K值 (填“增大”、“减小”或“不变”).
(2)根据题图判断,Q 0(填“>”、“<”或“=”)
(3)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)= (用含nB、tB的式子表示)
(4)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是
a 氢气的浓度减少 b 正反应速率加快,逆反应速率也加快
c 甲醇的物质的量增加 d 重新平衡时n(H2)/n(CH3OH)增大.

(1)反应达到平衡时,平衡常数表达式K=
(2)根据题图判断,Q
(3)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=
(4)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是
a 氢气的浓度减少 b 正反应速率加快,逆反应速率也加快
c 甲醇的物质的量增加 d 重新平衡时n(H2)/n(CH3OH)增大.
考点:化学平衡的影响因素
专题:化学平衡专题
分析:(1)根据方程式和K的含义书写;根据温度对平衡的影响,判断K的变化;
(2)图象分析,先拐先平温度高,温度越高甲醇物质的量越小,说明升温平衡逆向进行,正反应为放热反应;
(3)500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=2v(CH3OH)=2
;
(4)将处于E点的体系的体积压缩到原来的
,体系的压强增大,平衡向正反应方向移动,正逆反应速率都增大.
(2)图象分析,先拐先平温度高,温度越高甲醇物质的量越小,说明升温平衡逆向进行,正反应为放热反应;
(3)500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=2v(CH3OH)=2
| ||
| △t |
(4)将处于E点的体系的体积压缩到原来的
| 1 |
| 2 |
解答:
解:(1)已知CO(g)+2H2(g)?CH3OH(g),则K=
,500℃时甲醇的物质的量小,所以升高温度,平衡逆移,所以K减小;
故答案为:
;减小;
(2)图象分析,先拐先平温度高,温度越高甲醇物质的量越小,说明升温平衡逆向进行,正反应为放热反应Q<0,故答案为:<;
(3)500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=2v(CH3OH)=2
=2×
mol/(L.min)=
mol?l-1?min-1,故答案为:
mol?l-1?min-1;
(4)将处于E点的体系的体积压缩到原来的
,体系的压强增大,
a.体积减小,氢气的浓度增大,故a错误;
b.体系压强增大,正逆反应速率都增大,故b正确;
c.增大压强,平衡向正反应方向移动,则甲醇的物质的量增加,故c正确;
d.增大压强,平衡向正反应方向移动,且氢气的转化率大于原来体系,所以重新平衡时n(H2)/n(CH3OH)减小,故d错误;
故选bc.
| c(CH3OH) |
| c(CO)c2(H2) |
故答案为:
| c(CH3OH) |
| c(CO)c2(H2) |
(2)图象分析,先拐先平温度高,温度越高甲醇物质的量越小,说明升温平衡逆向进行,正反应为放热反应Q<0,故答案为:<;
(3)500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=2v(CH3OH)=2
| ||
| △t |
| ||
| t(B) |
| 2n(B) |
| 3t(B) |
| 2n(B) |
| 3t(B) |
(4)将处于E点的体系的体积压缩到原来的
| 1 |
| 2 |
a.体积减小,氢气的浓度增大,故a错误;
b.体系压强增大,正逆反应速率都增大,故b正确;
c.增大压强,平衡向正反应方向移动,则甲醇的物质的量增加,故c正确;
d.增大压强,平衡向正反应方向移动,且氢气的转化率大于原来体系,所以重新平衡时n(H2)/n(CH3OH)减小,故d错误;
故选bc.
点评:本题涉及化学平衡状态的判断、化学平衡移动的影响因素等知识点,根据方程式特点确定平衡移动影响因素,只有反应前后改变的物理量不变时才能作为化学平衡状态的判断依据,题目难度中等.

练习册系列答案
相关题目
下列分析正确的是( )
| A、将氯气通入H2O2和NaOH的混合溶液中,发出红光,说明反应物的总能量低于生成物的总能量,放出热量 |
| B、1mol H2在氯气中完全燃烧,放出180kJ热量,则键能(E)的关系为E(H-H)=180kJ+2E(H-Cl)-E(Cl-Cl) |
| C、干燥的碘粉与铝粉混合无明显现象,滴上一滴水会冉冉升起紫色的碘蒸气,最后得到白色AlI3.说明碘和铝发生的反应是放热反应 |
| D、精确实验测得H2O在常温下也能微弱电离:H2O?H++OH-,该过程是放热过程 |
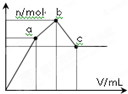 向100mL 0.1mol?L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol?L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.则下列说法中正确的是( )
向100mL 0.1mol?L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol?L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.则下列说法中正确的是( )| A、a点的溶液呈中性 |
| B、b点发生反应的离子方程式是:Al3++2SO42-+2Ba2++3OH-═Al(OH)3↓+2BaSO4↓ |
| C、c点加入Ba(OH)2溶液的体积为200mL |
| D、c点溶液呈碱性 |
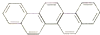 举世瞩目的2012年奥运会在伦敦召开,有一种有机物,因其酷似奥林匹克旗中的五环.科学家称其为奥林匹克烃,下列有关奥林匹克烃的说法正确的是( )
举世瞩目的2012年奥运会在伦敦召开,有一种有机物,因其酷似奥林匹克旗中的五环.科学家称其为奥林匹克烃,下列有关奥林匹克烃的说法正确的是( )| A、该烃的一氯代物只有六种 |
| B、该烃分子中只含非极性键 |
| C、该烃完全燃烧生成H2O的物质的量小于CO2的物质的量 |
| D、该烃属于苯的同系物 |
 ,试回答下列问题:
,试回答下列问题: