题目内容
15.汽车尾气中的主要污染物是NO和CO.为减轻大气污染,人们提出通过以下反应来处理汽车尾气:(1)2NO(g)+2CO(g)?2CO2(g)+N2(g)△H=-746.5KJ/mol (条件为使用催化剂)
已知:2C (s)+O2(g)?2CO(g)△H=-221.0KJ/mol
C (s)+O2(g)?CO2(g)△H=-393.5KJ/mol
则 N2(g)+O2(g)═2NO(g)△H=+180.5kJ•mol-1.
(2)T℃下,在一容积不变的密闭容器中,通入一定量的NO和CO,用气体传感器测得不同时间NO和CO的浓度如下表
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| C(NO)10-4 mol/L | 10.0 | 4.50 | C1 | 1.50 | 1.00 | 1.00 |
| C(CO)10-3 mol/L | 3.60 | 3.05 | C2 | 2.75 | 2.70 | 2.70 |
A.4.20 B.4.00 C.2.95 D.2.80
(3)研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率.根据下表设计的实验测得混合气体中NO的浓度随时间t变化的趋势如图1所示:
| 试验编号 | T/℃ | NO初始浓度/10-3mol•L-1 | CO初始浓度/10-3mol•L-1 | 催化剂的比表面积/m2•g1 |
| ① | 350 | 1.20 | 5.80 | 124 |
| ② | 280 | 1.20 | 5.80 | 124 |
| ③ | 280 | 1.20 | 5.80 | 82 |

则曲线Ⅱ对应的实验编号为②.
分析 (1)依据题干热化学方程式和盖斯定律计算得到所需热化学方程式,得到反应焓变;
(2)随反应的进行浓度减小,速率降低,根据3s时的浓度来求解;
(3)由图可知,曲线Ⅰ和曲线Ⅱ相比,平衡没有移动,反应速率Ⅱ比Ⅰ快,故曲线Ⅱ中催化剂比比表面积大于Ⅰ,而其它条件相同;而曲线Ⅲ和曲线Ⅱ相比,反应速率变快且平衡逆向移动,该反应为放热反应,升高温度平衡逆向移动;
解答 解:(1)①2NO(g)+2CO(g)?2CO2(g)+N2(g)△H=-746.5KJ/mol
②2C (s)+O2(g)?2CO(g)△H=-221.0KJ/mol
③C (s)+O2(g)?CO2(g)△H=-393.5KJ/mol
则依据盖斯定律计算③×2-②-①得到:N2(g)+O2(g)=2NO(g)△H=+180.5KJ/mol,
故答案为:+180.5;
(2)因为1s到2s的平均速率大于2s到3s的平均速率,即3.05-C2>C2-2.75,解之得C2<2.9,故选D;
(3)由于②、③温度相同,催化剂对平衡移动无影响,化学平衡不移动,达到相同的平衡状态,但②的起始浓度较大,催化剂的比表面积较大,则反应的速率大,所以②先达到化学平衡;
由于①、②浓度、催化剂的比面积大相同,而①的温度较高,反应速率较快,先到达平衡,且平衡向逆反应移动,平衡时NO的浓度增大,
所以曲线Ⅰ对应实验③,曲线Ⅱ对应实验②,曲线Ⅲ对应实验①,故答案为:②.
点评 本题比较综合,属于拼合型题目,涉及热化学方程式书写、化学反应速率计算与影响因素、化学平衡图等,是对学生综合能力的考查,学生容易考虑浓度减小确定区间,忽略反应速率问题.

练习册系列答案
相关题目
5.用NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A. | 0.1mol•L-1稀硫酸中含有硫酸根个数为0.1NA | |
| B. | 7.8g过氧化钠与足量水充分反应转移电子0.1NA | |
| C. | 2.4g金属镁与足量的盐酸反应,生成氢气的体积为2.24L | |
| D. | 标准状况下,0.5NA个水分子所占体积是11.2L |
20.下列各项比较中前者高于(或大于或强于)后者的是( )
| A. | CCl4和SiCl4的熔点 | |
| B. | 邻羟基苯甲醛( )和对羟基苯甲醛( )和对羟基苯甲醛(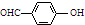 )的沸点 )的沸点 | |
| C. | HF和HCl在水中的溶解度 | |
| D. | H2SO3和H2SO4的酸性 |
4.如图所示装置中a、b为惰性电极,通电后,Cu电极上有气体产生,甲装置中溶液变蓝色.则下列说法正确的是( )
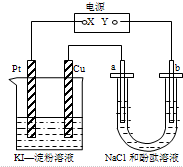

| A. | X可以是电源的负极,也可以是电源的正极 | |
| B. | 甲装置的电池反应是:2Cu2++4I-=2CuI↓+I2 | |
| C. | 乙装置a电极周围溶液变红色,pH变大 | |
| D. | 乙装置中Na+向b电极迁移 |
9.下图微粒的结构示意图,正确的是( )
| A. |  Mg2+ Mg2+ | B. |  Cl Cl | C. |  Ar Ar | D. | K  |