题目内容
由CO、CO2组成的混合气体36g,其中含C原子数为NA个,则C、O原子个数比为( )
| A、1:3 | B、2:3 |
| C、1:1 | D、4:3 |
考点:物质分子中的原子个数计算
专题:阿伏加德罗常数和阿伏加德罗定律
分析:根据碳原子守恒计算混合气体的物质的量,计算当该气体完全是一氧化碳时的质量,则混合气体中多出的质量是氧元素的质量,再根据原子守恒计算混合物中C、O原子个数比
解答:
解:混合气体中含C原子数为NA个,根据其化学式特点及原子守恒知,混合气体的物质的量是1mol,
1mol一氧化碳的质量是28g,则剩余的8g是二氧化碳中氧元素,其物质的量=
=0.5mol,
所以混合气体中C的物质的量是1mol,O原子是物质的量是(1+0.5)mol=1.5mol,所以C、O原子个数比1mol:1.5mol=2:3,
故选B.
1mol一氧化碳的质量是28g,则剩余的8g是二氧化碳中氧元素,其物质的量=
| 36g-28g |
| 16g/mol |
所以混合气体中C的物质的量是1mol,O原子是物质的量是(1+0.5)mol=1.5mol,所以C、O原子个数比1mol:1.5mol=2:3,
故选B.
点评:本题考查了分子中原子个数计算,中等难度.根据CO、CO2组成特点进行计算是较为简便的方法.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列溶液中物质的量浓度为1mol/L的是( )
| A、将40 g NaOH溶解在1 L水中 |
| B、将22.4 L HCl气体溶于水配成1 L溶液 |
| C、将1 L 10 mol/L浓盐酸加入9 L水中 |
| D、将10 g NaOH溶解在少量水中,再加蒸馏水直到溶液体积为250 mL |
下列叙述正确的是( )
| A、1mol钠与O2反应生成Na2O 或Na2O2,转移的电子数目均为2NA |
| B、1molO2和足量的Mg或Al完全反应,电子转移数目之比为2:3 |
| C、Na、Mg、Al各1mol和足量的O2反应,电子转移数目之比为1:2:3 |
| D、Cu、Mg各1mol在O2中充分燃烧,电子转移数目之比为3:2 |
下列物质都是食品添加剂,但使用时必须严格控制用量的是( )
| A、食醋 | B、蔗糖 |
| C、料酒 | D、亚硝酸钠 |
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.高铁电池的总反应为:3Zn+2K2FeO4+8H2O
3Zn(OH)2+2Fe(OH)3+4KOH
下列叙述不正确的是( )
| 放电 |
| 充电 |
下列叙述不正确的是( )
| A、放电时负极反应为:Zn-2e-+2OH-=Zn(OH)2 |
| B、放电时每转移3 mol电子,正极有1mol K2FeO4被还原 |
| C、充电时阳极反应为:Fe(OH)3-3e-+5 OH-=FeO42-+4H2O |
| D、放电时正极附近溶液的碱性减弱 |
下列电解质的电离方程式书写正确的是( )
| A、NaHCO3═Na++H++CO32- |
| B、KClO3═K++Cl-+3O2- |
| C、NaHSO4═Na++H++SO42- |
| D、NH3?H2O═NH4++OH- |
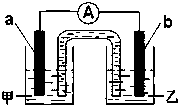 一个完整的氧化还原反应方程式可以拆写成两个“半反应式”,一个是“氧化反应式”,一个是“还原反应式”.如2Fe3++Cu═2Fe2++Cu2+,可拆写为氧化反应式:Cu-2e-═Cu2+,还原反应式:2Fe3++2e-=2Fe2+.并由此实现了化学能与电能的相互转化.据此,回答下列问题:
一个完整的氧化还原反应方程式可以拆写成两个“半反应式”,一个是“氧化反应式”,一个是“还原反应式”.如2Fe3++Cu═2Fe2++Cu2+,可拆写为氧化反应式:Cu-2e-═Cu2+,还原反应式:2Fe3++2e-=2Fe2+.并由此实现了化学能与电能的相互转化.据此,回答下列问题: