题目内容
下列电解质的电离方程式书写正确的是( )
| A、NaHCO3═Na++H++CO32- |
| B、KClO3═K++Cl-+3O2- |
| C、NaHSO4═Na++H++SO42- |
| D、NH3?H2O═NH4++OH- |
考点:电离方程式的书写
专题:离子反应专题
分析:先判断强电解质与弱电解质,然后根据强电解质在溶液中完全电离、弱电解质在溶液中部分电离进行判断,注意酸根离子为原子团的,如氯酸根离子、氯酸根离子,在电离方程式中需要保留整体,据此进行解答.
解答:
解:A.碳酸氢钠在溶液中完全电离出钠离子和碳酸氢根离子,碳酸氢根离子不能拆开,正确的电离方程式为:NaHCO3═Na++HCO3-,故A错误;
B.氯酸钾为强电解质,在溶液中完全电离出钾离子和氯酸根离子,正确的电离方程式为:KClO3═K++ClO3-,故B错误;
C.硫酸氢钠在溶液中完全出钠离子、氢离子和硫酸根离子,其电离方程式为:NaHSO4═Na++H++SO42-,故C正确;
D.一水合氨为弱电解质,在溶液中部分电离,应该使用可逆号,正确的电离方程式为:NH3?H2O?NH4++OH-,故D错误;
故选C.
B.氯酸钾为强电解质,在溶液中完全电离出钾离子和氯酸根离子,正确的电离方程式为:KClO3═K++ClO3-,故B错误;
C.硫酸氢钠在溶液中完全出钠离子、氢离子和硫酸根离子,其电离方程式为:NaHSO4═Na++H++SO42-,故C正确;
D.一水合氨为弱电解质,在溶液中部分电离,应该使用可逆号,正确的电离方程式为:NH3?H2O?NH4++OH-,故D错误;
故选C.
点评:本题考查了电离方程式的书写判断,题目难度中等,注意掌握强弱电解质的概念及电离方程式的书写原则,试题培养了学生灵活应用所学知识的能力.

练习册系列答案
相关题目
由CO、CO2组成的混合气体36g,其中含C原子数为NA个,则C、O原子个数比为( )
| A、1:3 | B、2:3 |
| C、1:1 | D、4:3 |
原电池在工作时,发生氧化还原反应,下列反应不可能作为原电池工作时发生的反应的是( )
| A、Cu+2AgNO3═Cu(NO3)2+2Ag |
| B、2Fe+O2+2H2O═2Fe(OH)2 |
| C、NaOH+HCl═NaCl+H2O |
| D、2H2+O2═2H2O |
下列电子式书写正确的是( )
A、 |
B、 |
C、 |
D、 |
能说明A元素的非金属性比B元素的非金属性强的是( )
| A、A原子得到电子的数目比B原子少 |
| B、A元素的最高正价比B元素的最高正价要高 |
| C、气态氢化物的稳定性:A比B弱 |
| D、A单质能与B的氢化物水溶液反应,生成B单质 |
下列实验事实不能用平衡移动原理解释的是( )
A、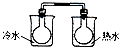 NO2球浸在冷水和热水中 | ||||||||
B、
| ||||||||
C、 | ||||||||
D、
|
下列关于容量瓶及其使用方法的叙述,正确的是( )
①是配制一定物质的量的浓度的溶液的专用仪器 ②使用前要先检查容量瓶是否漏液 ③容量瓶可以用来加热 ④不能用容量瓶贮存配制好的溶液 ⑤可以用500mL容量瓶配制250mL溶液.
①是配制一定物质的量的浓度的溶液的专用仪器 ②使用前要先检查容量瓶是否漏液 ③容量瓶可以用来加热 ④不能用容量瓶贮存配制好的溶液 ⑤可以用500mL容量瓶配制250mL溶液.
| A、①和② | B、①和④ |
| C、除了③ | D、除了③⑤ |
某恒温密闭容器中,可逆反应A(s)?B(?)+C(g)△H=+QKJ/mol(Q>0),达到平衡.缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等.以下分析正确的是( )
| A、产物B的状态可能为气态、固态或液态 |
| B、平衡时,单位时间内m(A)消耗﹕m(C)消耗=1﹕1 |
| C、保持体积不变,向平衡体系中加入B,平衡可能不移动 |
| D、若开始时向容器中加入1molB和1molC,达到平衡时放出热量QKJ |