题目内容
15.硫单质及其化合物在工农业生产中有着重要的应用,请回答下列问题: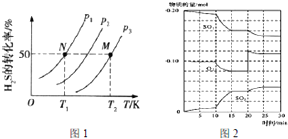
(1)一种煤炭脱硫技术可以把硫元素以CaSO4的形成固定下来,但产生的CO又会与CaSO4发生化学反应,相关的热化学方程式如下:
①CaSO4(s)+CO(g)?CaO(s)+SO2(g)+CO2(g)△=+210.5kJ•mol-1
②$\frac{1}{4}$CaSO4(s)+CO(g)?$\frac{1}{4}$CaS(s)+CO2(g)△=-47.3kJ•mol-1
反应:CaO(s)+3CO(g)+SO2(g)?CaS(s)+3CO2(g)△=-399.7kJ•mol-1
(2)图1为密闭容器中H2S气体分解生产H2和S2(g)的平衡转化率与温度、压强的关系.
图1中压强P1、P2、P3的大小顺序为P1<P2<P3,理由是反应前后气体体积增大,增大压强平衡逆向进行,该反应平衡常数的大小关系为K(T1)<K(T2)(碳“>”“=”或“<”)理由是反应是吸热反应,升温平衡正向进行,平衡常数增大
(3)在一定条件下,二氧化硫和氧气发生反应:2S02(g)+02(g)?2SO3△H<0
①600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图2,反应处于平衡状态的时间段所示15-20min和25-30min
②据图2判断,反应进行至20min时,曲线发生变化的原因是增大氧气的浓度(用文字表达):10min到15min的曲线变化的原因可能是ab(填写编号)
A.加了催化剂
B.缩小容器体积
C.降低温度
D.增加SO2的物质的量
(4)烟气中SO2可用某浓度NaOH溶液吸收得到Na2SO3和NaHSO3混合溶液,且所得溶液呈中性,该溶液中c(Na+)=2c(SO32-)+c(HSO3-)(用含硫微粒浓度的代数式表示)
分析 (1)利用盖斯定律将②×4-①可得CaO(s)+3CO(g)+SO2(g)?CaS(s)+3CO2(g)反应热;
(2)H2S气体分解生产H2和S2(g)的反应为2H2S$\frac{\underline{\;高温\;}}{\;}$2H2+S2,反应前后气体体积增大,同温度下,压强越大,平衡逆向进行,H2S转化率减小,温度升高,H2S的转化率增大,说明正反应为吸热反应,升温平衡正向进行,平衡常数增大;
(3)①反应混合物各物质的物质的量不变化,说明反应处于平衡状态;
②由图可知,反应进行至20min时,改变体积,平衡向正反应移动,瞬间只有氧气的浓度增大;由图可知,反应向正反应进行,10min到15min反应混合物单位时间内的变化量增大,说明反应速率增大,10min改变瞬间,各物质的物质的量不变;
(4)依据溶液中存在的电荷守恒分析;
解答 解:(1)利用盖斯定律将②×4-①可得CaO(s)+3CO(g)+SO2(g)?CaS(s)+3CO2(g)△H=4×(-47.3kJ•mol-1)-(210.5kJ•mol-1)=-399.7kJ•mol-1,
故答案为:-399.7;
(2)H2S气体分解生产H2和S2(g)的反应为2H2S$\frac{\underline{\;高温\;}}{\;}$2H2+S2,反应前后气体体积增大,同温度下,压强越大,平衡逆向进行,H2S转化率减小,则P1<P2<P3,温度升高,H2S的转化率增大,说明正反应为吸热反应,升温平衡正向进行,平衡常数增大,K(T1)<K(T2),
故答案为:P1<P2<P3;反应前后气体体积增大,增大压强平衡逆向进行;<;反应是吸热反应,升温平衡正向进行,平衡常数增大;
(3)①反应混合物各物质的物质的量不变化,说明反应处于平衡状态,由图可知在15-20min和25-30min出现平台,各组分的物质的量不变,反应处于平衡状态,
故答案为:15-20min和25-30min;
②由图可知,反应进行至20min时,平衡向正反应移动,瞬间只有氧气的浓度增大,应是增大了氧气的浓度.由图可知,反应向正反应进行,10min到15min反应混合物单位时间内的变化量增大,说明反应速率增大,10min改变瞬间,各物质的物质的量不变.
a.加了催化剂,增大反应速率,故a正确;
b.缩小容器体积,增大压强,增大反应速率,故b正确;
c.降低温度反应速率降低,故c错误;
d.10min改变瞬间,各物质的物质的量不变,不是增加SO2的物质的量,故d错误;
故答案为:增大氧气的浓度;ab;
(4)烟气中的SO2可用某浓度NaOH溶液吸收得到Na2SO3和NaHSO3混合溶液,且所得溶液呈中性,依据溶液中电荷守恒分析,c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),c(H+)=c(OH-),得到(Na+)=2c(SO32-)+c(HSO3-),故答案为:2c(SO32-)+c(HSO3-);
点评 本题考查了热化学方程式书写方法,化学平衡建立,平衡状态影响因素分析,化学反应速率、平衡常数计算应用,电解质溶液电荷守恒,掌握基础是关键,题目难度中等.

请回答下列问题:
(1)煤的气化的主要化学反应方程式为:C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2.
(2)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)═CH3OH(g);△H=-90.8kJ•mol-1
②2CH3OH(g)═CH3OCH3(g)+H2O(g);△H=-23.5kJ•mol-1
③CO(g)+H2O(g)═CO2(g)+H2(g);△H=-41.3kJ•mol-1
总反应:3H2(g)+3CO(g)═CH3OCH3(g)+CO2 (g)的△H=-246.4 kJ•mol-1;一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是ce(填字母代号).
a.高温高压 b.加入催化剂 c.减少CO2的浓度
d.增加CO的浓度 e.分离出二甲醚
(3)已知反应②2CH3OH(g)═CH3OCH3(g)+H2O(g)某温度下的平衡常数为400.此温度下,在密闭恒容容器中加入CH3OH,反应到某时刻测得各组分浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol•L-1) | 0.44 | 0.6 | 0.6 |
②若加入CH3OH后,经10min反应达到平衡,此时c(CH3OH)=0.04 mol•L-1;该时间内反应速率v(CH3OH)=0.16 mol/(L•min).
③下列措施中能说明反应达到平衡状态的是D
A.体系压强保持不变 B.混合气体的密度保持不变
C.CH3OH与H2O的浓度之比为1:2
D.单位时间内,消耗2mol CH3OH的同时消耗1molH2O.
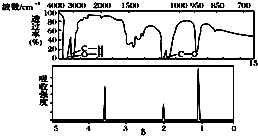
| A. | 由核磁共振氢谱可知,该有机物中至少有三种不同的化学键 | |
| B. | 由红外光谱可知,该有机物分子中有三种不同的氢原子 | |
| C. | 若A的化学式为C2H6O,则其结构简式为CH3-O-CH3 | |
| D. | 仅由其核磁共振氢谱无法得知其分子中的氢原子总数 |
| A. | C17H19NO3 | B. | C17H21NO4 | C. | C17H25NO3 | D. | C25H27NO7 |
| 选项 | 实验目的 | 操作 | 现象 |
| A | 比较酸性:HF>H2CO3 | 向盛有少量NaHCO3溶液的试管中滴加足量HF溶液 | 有无色气体产生 |
| B | 验证SO2的漂白性 | 将SO2通入石蕊溶液中 | 石蕊溶液褪色 |
| C | 比较非金属性:Br>I | 将溴水滴加到KI-淀粉溶液中 | 溶液变蓝 |
| D | 检验某溶液中是否含有SO42- | 向盛有少量待测液的试管中先滴加Ba(NO3)2溶液,再滴加稀盐酸 | 有白色沉淀生成 |
| A. | A | B. | B | C. | C | D. | D |
| A. | (A-x+n) mol | B. | (A-x-n) mol | C. | (A-x+n)$\frac{w}{A}$ mol | D. | (A-x-n)$\frac{w}{A}$ mol |
| 晶体 | NaCl | KCl | AlCl3 | SiCl4 | 单质B |
| 熔点/℃ | 810 | 776 | 190 | -68 | 2300 |
| 沸点/℃ | 1465 | 1418 | 180 | 57 | 2500 |
| A. | SiCl4是分子晶体 | B. | 单质B可能是原子晶体 | ||
| C. | AlCl3加热能升华 | D. | NaCl中化学键的强度比KCl中的小 |
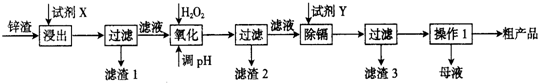
 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.