题目内容
3.炼锌厂产生的工业废渣-锌渣(除了含Zn外,还含有Fe、Al、Cd和SiO2等杂质),利用锌渣制取并回收ZnSO4•7H2O和金属镉是一个有益的尝试,其流程如下: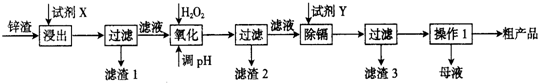
已知:Fe3+、Al3+、Zn2+、Cd2+、Fe2+以氢氧化物完全沉淀时的pH分别为:3.2,4.7,6.5,9.4,9.7;锌的金属活动性比镉强.
试回答下列问题:
(1)“浸出”时用到的“试剂X”为硫酸溶液(填名称).
(2)写出“氧化”过程的离子方程式2H++H2O2+2Fe2+=2Fe3++2H2O.
(3)“调pH”过程可以选用BD.(从以下选项选择,填序号)
A.H2SO4 B.ZnO C.NaOH D.ZnCO3
“滤渣2”的主要成分是Fe(OH)3和Al(OH)3(填化学式,下同).
(4)“试剂Y”是Zn;写出除去Cd2+的化学方程式Zn+CdSO4=ZnSO4+Cd.
(5)“操作1”的方法是蒸发浓缩、冷却结晶、过滤洗涤;在“操作1”时,必须采取的实验措施是保持溶液一定的酸度.
分析 炼锌厂产生的工业废渣-锌渣(除了含Zn外,还含有Fe、Al、Cd和SiO2等杂质),加入试剂X为硫酸酸溶浸出,过滤得到滤渣1,得到溶液中加入过氧化氢用来氧化亚铁离子为铁离子,调节溶液PH使铁离子、铝离子沉淀,过滤得到滤渣2和滤液,滤液中加入试剂Y为锌,置换反应除去铬过滤得到滤渣3为铬,得到硫酸锌溶液,通过蒸发浓缩、冷却结晶、过滤洗涤、干燥得到粗产品,
(1)根据Zn、Fe、Al、Cd、SiO2中,只有二氧化硅不能和硫酸反应,可以用硫酸将之溶解;
(2)双氧水是绿色氧化剂,能将亚铁离子氧化为三价铁离子;
(3)“调pH”过程不能引入杂质离子,据此来选择试剂,该试剂可以将三价铁和铝离子沉淀下来;
(4)金属Cd的活泼性比金属锌差,可以用金属锌能来置换金属铬,为将金属铬全部置换往往加入过量的金属锌;
(5)从硫酸锌溶液中获得纯净的硫酸锌的晶体的方法是加热浓缩、蒸发结晶、过滤洗涤,但是一定要防止金属阳离子的水解.
解答 解:(1)Zn、Fe、Al、Cd、SiO2中,只有二氧化硅不能和硫酸反应,可以用硫酸将之溶解,过滤,先获得二氧化硅,
故答案为:硫酸溶液;
(2)为了将杂质离子铝离子以及三价铁离子沉淀下来,结合离子沉淀的条件,首先要将亚铁离子氧化为三价铁离子,然后再将之形成沉淀,反应实质是:2H++H2O2+2Fe2+=2Fe3++2H2O,
故答案为:2H++H2O2+2Fe2+=2Fe3++2H2O;
(3)“调pH”过程能使得溶液的碱性增强,同时不能引入杂质离子,据此能选择试剂氧化锌、碳酸锌,该试剂可以将三价铁和铝离子沉淀下来,形成Fe(OH)3、Al(OH)3,
故答案为:BD;Fe(OH)3、Al(OH)3;
(4)金属Cd的活泼性比金属锌差,可以用金属锌能来置换金属铬,为将金属铬全部置换往往加入过量的金属锌,所以“试剂Y”是金属锌,“滤渣3”的成分为剩余的金属锌和置换出的金属铬,除去Cd2+的化学方程式为:Zn+CdSO4=ZnSO4+Cd,
故答案为:Zn;Zn+CdSO4=ZnSO4+Cd;
(5)从硫酸锌溶液中获得纯净的硫酸锌的晶体的方法是加热浓缩、蒸发结晶、过滤洗涤,但是要注意保持溶液一定的酸度,防止金属阳离子的水解,
故答案为:蒸发浓缩、蒸发结晶、过滤洗涤;保持溶液一定的酸度.
点评 本题是一道综合知识题目,考查的范围较广,主要是物质的分离提纯、金属回收、离子性质等知识的应用,题目难度中等.

| A. | 左下方 | B. | 右上方 | C. | 右下方 | D. | 左上方 |
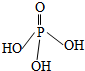 三聚磷酸可视为三个磷酸分子(磷酸结构式如图)之间脱去两个水分子的产物,三聚磷酸钠(俗称“五钠”)是常用的水处理剂.下列说法错误的是( )
三聚磷酸可视为三个磷酸分子(磷酸结构式如图)之间脱去两个水分子的产物,三聚磷酸钠(俗称“五钠”)是常用的水处理剂.下列说法错误的是( )| A. | 三聚磷酸中P的化合价为+5 | |
| B. | 三聚磷酸钠的化学式为Na3P3O10 | |
| C. | 按上述原理,四聚磷酸的化学式为H6P4O13 | |
| D. | 多聚磷酸的结构可表示为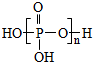 |





