题目内容
粗盐中一般含有CaCl2、MgCl2、CaSO4和MgSO4杂质.从粗盐制得精盐的过程如下: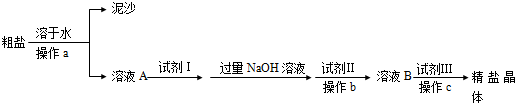
①各操作分别是:操作a 、操作c .
②各试剂分别是:试剂Ⅰ 、试剂Ⅱ 、试剂Ⅲ .
③加入试剂Ⅱ所发生反应的化学方程式为 、 .
④操作b与试剂Ⅲ的顺序能否交换?为什么? 、 .

①各操作分别是:操作a
②各试剂分别是:试剂Ⅰ
③加入试剂Ⅱ所发生反应的化学方程式为
④操作b与试剂Ⅲ的顺序能否交换?为什么?
考点:粗盐提纯
专题:实验设计题
分析:①用于分离不溶性固体和液体采取过滤操作,从氯化钠溶液中获得氯化钠固体采取蒸发操作;
②除去硫酸根离子用钡离子沉淀,除去镁离子用氢氧根离子进行沉淀,除去钙离子用碳酸根离子进行沉淀,过量的钡离子需要用碳酸根离子除去,再向滤液中加入适量的盐酸得到精盐水,以此分析.
③粗盐的提纯中,加入碳酸钠的作用是除去杂质离子钙离子以及过量的钡离子.
②除去硫酸根离子用钡离子沉淀,除去镁离子用氢氧根离子进行沉淀,除去钙离子用碳酸根离子进行沉淀,过量的钡离子需要用碳酸根离子除去,再向滤液中加入适量的盐酸得到精盐水,以此分析.
③粗盐的提纯中,加入碳酸钠的作用是除去杂质离子钙离子以及过量的钡离子.
解答:
解:粗盐溶于水,过滤,可以将泥沙除掉,除去硫酸根离子用钡离子沉淀,可以加过量的氯化钡,除去镁离子用氢氧根离子进行沉淀,可以加过量的氢氧化钠,除去钙离子用碳酸根离子进行沉淀,可以加过量的碳酸钠,过量的钡离子需要用碳酸钠除去,最后再向滤液中加入适量的盐酸得到精盐水,加入试剂的原则是:碳酸钠加在氯化钡以后,最后加入盐酸,出去氢氧化钠和过量的碳酸钠.
①粗盐溶于水,过滤,可以将泥沙除掉,最后将溶液蒸发,可以除去过量的盐酸,故答案为:过滤;蒸发;
②过程中先后加入的试剂依次是BaCl2溶液、氢氧化钠、Na2CO3溶液、盐酸,故答案为:BaCl2溶液;Na2CO3溶液;盐酸;
③加入碳酸钠可以和氯化钡反应,可以氯化钙发生反应,反应的方程式为:CaCl2+Na2CO3═CaCO3↓+2NaCl,BaCl2+Na2CO3═BaCO3↓+2NaCl,
故答案为:CaCl2+Na2CO3═CaCO3↓+2NaCl;BaCl2+Na2CO3═BaCO3↓+2NaCl;
④试剂Ⅲ是盐酸、可以和氢氧化镁、碳酸钙以及碳酸钡发生反应生成氯化镁、氯化钙、氯化钡,这样除去的杂质离子又会生成,所以操作b与试剂Ⅲ的顺序不能交换,
故答案为:不能交换;因盐酸能将前面生成的沉淀氢氧化镁、碳酸钙和碳酸钡溶解而产生新的杂质.
①粗盐溶于水,过滤,可以将泥沙除掉,最后将溶液蒸发,可以除去过量的盐酸,故答案为:过滤;蒸发;
②过程中先后加入的试剂依次是BaCl2溶液、氢氧化钠、Na2CO3溶液、盐酸,故答案为:BaCl2溶液;Na2CO3溶液;盐酸;
③加入碳酸钠可以和氯化钡反应,可以氯化钙发生反应,反应的方程式为:CaCl2+Na2CO3═CaCO3↓+2NaCl,BaCl2+Na2CO3═BaCO3↓+2NaCl,
故答案为:CaCl2+Na2CO3═CaCO3↓+2NaCl;BaCl2+Na2CO3═BaCO3↓+2NaCl;
④试剂Ⅲ是盐酸、可以和氢氧化镁、碳酸钙以及碳酸钡发生反应生成氯化镁、氯化钙、氯化钡,这样除去的杂质离子又会生成,所以操作b与试剂Ⅲ的顺序不能交换,
故答案为:不能交换;因盐酸能将前面生成的沉淀氢氧化镁、碳酸钙和碳酸钡溶解而产生新的杂质.
点评:本题考查了粗盐提纯实验,题目难度一般,首先要知道除去的杂质的离子的性质,然后选择合适的试剂和滴加顺序进行除杂,一般加碳酸根离子要放在加钡离子之后,可以将剩余的钡离子除去,除杂的结果,最后只能有先氯化钠,也就是氯离子和钠离子.

练习册系列答案
相关题目
下列化学用语正确的是( )
| A、乙烯的分子式:CH2═CH2 |
| B、次氯酸分子的结构式:H-O-Cl |
C、羟基的电子式: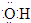 |
| D、以铁作阳极电解时,阳极的电极反应式:Fe-3e-═Fe3+ |
 单质硼有无定形和晶体两种,参考下列数据.
单质硼有无定形和晶体两种,参考下列数据.
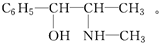
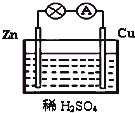 如图为原电池的示意图.请回答:
如图为原电池的示意图.请回答: