题目内容
15.某元素原子价电子构型为3d54S2,该元素位于元素周期表的( )| A. | s区 | B. | p区 | C. | d区 | D. | ds区 |
分析 s区的外围电子排布为nsx(氦除外),包含第ⅠA、ⅡA族元素,p区的外围电子排布为ns2npx(包含氦氦元素,氦除外),包含ⅢA~ⅦA族元素与零族元素,ds区的外围电子排布为nd10(n+1)sx,包含ⅠB、ⅡB元素,d区的外围电子排布为ndx(n+1)sy,x不等于10,包含ⅢB~ⅦB族元素与第Ⅷ族元素,据此判断.
解答 解:元素原子价电子构型为3d54S2的元素为Mn元素,处于第四周期ⅦB,处于d区,故选C.
点评 本题考查结构与物质关系,难度不大,注意掌握元素周期表中各区的划分.

练习册系列答案
相关题目
7.现将6.96g 的MnO2与100g 35.6%的盐酸(盐酸足量)共热,向反应后的溶液中加水稀释到250mL,取25mL跟足量的AgNO3溶液反应.若不考虑HCl的挥发,下列说法正确的是( )
| A. | 产生氯气1.792L | B. | 生成AgCl沉淀11.7g | ||
| C. | 被还原的HCl为0.16mol | D. | 转移的电子数为0.16个 |
8.下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
| 选项 | 实验 | 现象 | 结论 |
| A | 向某无色溶液中滴加氯水后,再滴加淀粉溶液 | 溶液变为蓝色 | 原溶液为KI溶液 |
| B | 向10mL浓度均为0.1mol/L的MgCl2和CuCl2的混合溶液中滴加一滴0.1mol/L的NaOH溶液 | 出现蓝色沉淀 | Ksp[Mg(OH)2]>Ksp[Cu(OH)2] |
| C | 向某未知溶液中滴加稀盐酸后产生无色气体,气体通入品红溶液中 | 品红溶液褪色 | 原溶液中有SO32- |
| D | 用刚洗净未干燥的容量瓶配制0.1mol/L的NaOH溶液 | 所配制的溶液浓度偏小 |
| A. | A | B. | B | C. | C | D. | D |
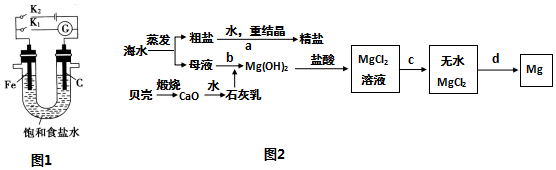
3.工业上以黄铁矿(FeS2)为原料,采用接触法生产硫酸的流程图如下.
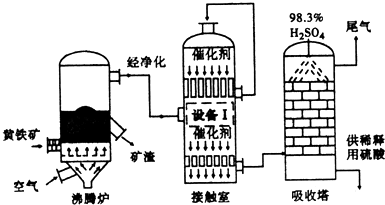
(1)黄铁矿在沸腾炉中反应的化学方程式为4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2.
(2)为充分利用反应放出的热最,接触室中应安装热交换器(填“设备I”的名称).
(3)原料气在一定条件下通人接触室中,测量各截面过程气体流中各种气体的物质的量的百分含量如下,则该过程中SO2的平衡转化率为91.7%(精确到0.1).
(4)在吸收塔中将SO3转化成硫酸,使用98.3%的硫酸从上方喷淋.而不使用水的理由是防止形成酸雾.吸收塔中填充有许多瓷管,其作用是增加SO3与浓硫酸的接触面,有利于SO3的吸收.
(5)尾气中常含有N2、O2、SO2、微量的SO3等.为了综合利用尾气,可将其通入氨水中,再按一定比例加入碳酸氢铵,降低温度析出含结晶水的晶体.已知该结晶水合物的相对分子质量为134,则其化学式为(NH4)2SO3•H2O.
(6)能用于测定硫酸尾气中SO2含量的是BC(填标号).
A.NaOH溶液、酚酞试液
B.KMnO4溶液、稀H2SO4
C.碘水、淀粉溶液
D.氨水、酚酞试液.

(1)黄铁矿在沸腾炉中反应的化学方程式为4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2.
(2)为充分利用反应放出的热最,接触室中应安装热交换器(填“设备I”的名称).
(3)原料气在一定条件下通人接触室中,测量各截面过程气体流中各种气体的物质的量的百分含量如下,则该过程中SO2的平衡转化率为91.7%(精确到0.1).
| 截面位置 含量 过程气体流 | 1(接触室人口处) | 2 | 3 | 4 |
| O2物质的量的百分含量 | 11.0% | 10.10% | 8.48% | 8.48% |
| SO2物质的量的百分含量 | 6.00% | 4.04% | 0.51% | 0.51% |
| SO3物质的量的百分含量 | 1.00% | 3.03% | 6.68% | 6.68% |
| N2物质的量的百分含量 | 81.00% | 81.83% | 83.31% | 83.31% |
(5)尾气中常含有N2、O2、SO2、微量的SO3等.为了综合利用尾气,可将其通入氨水中,再按一定比例加入碳酸氢铵,降低温度析出含结晶水的晶体.已知该结晶水合物的相对分子质量为134,则其化学式为(NH4)2SO3•H2O.
(6)能用于测定硫酸尾气中SO2含量的是BC(填标号).
A.NaOH溶液、酚酞试液
B.KMnO4溶液、稀H2SO4
C.碘水、淀粉溶液
D.氨水、酚酞试液.
10.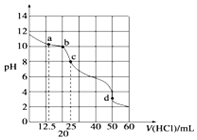 在常温下,0.10mol•L-1Na2CO3溶液25mL 用0.10mol•L-1盐酸滴定,其滴定曲线如图.对滴定过程中所得溶液中相关离子浓度间的关系,下列有关说法正确的是( )
在常温下,0.10mol•L-1Na2CO3溶液25mL 用0.10mol•L-1盐酸滴定,其滴定曲线如图.对滴定过程中所得溶液中相关离子浓度间的关系,下列有关说法正确的是( )
 在常温下,0.10mol•L-1Na2CO3溶液25mL 用0.10mol•L-1盐酸滴定,其滴定曲线如图.对滴定过程中所得溶液中相关离子浓度间的关系,下列有关说法正确的是( )
在常温下,0.10mol•L-1Na2CO3溶液25mL 用0.10mol•L-1盐酸滴定,其滴定曲线如图.对滴定过程中所得溶液中相关离子浓度间的关系,下列有关说法正确的是( )| A. | a点:c(CO32-)=c(HCO-3)>c(OH-) | B. | b点:5c(Cl-)>4c(HCO-3)+4c(CO2-3) | ||
| C. | c点:c(OH-)=c(H+)+c(HCO-3)+2c(H2CO3) | D. | d点:c(H+)=c(CO2-3)+c(HCO-3)+c(OH-) |
7.某些建筑材料含有放射性元素氡(22286Rn).研究表明氡的α射线会致癌,WHO认定的19种致癌因素中,氡为其中之一,仅次于吸烟.该原子中中子数和质子数之差是( )
| A. | 136 | B. | 50 | C. | 86 | D. | 222 |
5.下列变化中,需加入还原剂才能实现的是( )
| A. | HCO3-→CO32- | B. | MnO2→Mn2+ | C. | FeO→Fe3O4 | D. | Cl-→Cl2 |