题目内容
5.下列变化中,需加入还原剂才能实现的是( )| A. | HCO3-→CO32- | B. | MnO2→Mn2+ | C. | FeO→Fe3O4 | D. | Cl-→Cl2 |
分析 变化中某元素的化合价降低,发生还原反应,则一般需要加入还原剂才能实现氧化还原反应.
解答 解:A.HCO3-→CO32-中没有元素化合价发生变化,则不需要加入还原剂实现,故A错误;
B.MnO2→Mn2+中Mn元素化合价降低,被还原,应加入还原剂,故B正确;
C.FeO→Fe3O4中Fe元素的化合价部分升高,发生了氧化反应,则需要加入氧化剂才能实现,故C错误;
D.Cl-→Cl2中Cl元素的化合价升高,发生了氧化反应,则需要加入氧化剂才能实现,故D错误.
故选B.
点评 本题考查氧化还原反应,明确元素的化合价降低时物质被还原、元素的化合价升高时被氧化是解答本题的关键,难度不大.

练习册系列答案
相关题目
15.某元素原子价电子构型为3d54S2,该元素位于元素周期表的( )
| A. | s区 | B. | p区 | C. | d区 | D. | ds区 |
16.NaCl是一种化工原料,可以制一系列物质(如图).下列说法正确的是( )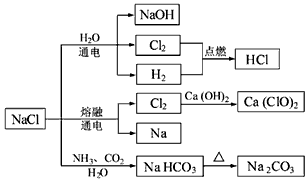

| A. | 石灰乳与Cl2的反应中,Cl2既作氧化剂,又作还原剂 | |
| B. | 25℃,NaHCO3在水中的溶解度比Na2CO3的大 | |
| C. | 图示的转化反应中有3个分解反应 | |
| D. | 图示的转化反应都是氧化还原反应 |
13.下列有关物质性质的应用正确的是( )
| A. | 常温下干燥氯气与铁不反应,可以用钢瓶储存氯水 | |
| B. | 浓硫酸、浓硝酸都具有强氧化性,不能盛放在金属容器中 | |
| C. | 石英玻璃耐强酸强碱,高温下可用来熔融氢氧化钠 | |
| D. | Na2SiO3是制备硅胶和木材防火剂的原料 |
10.硅及其化合物是带来人类文明的重要物质.下列说法正确的是( )
| A. | 陶瓷、水晶、水泥、玻璃都属于硅酸盐 | |
| B. | SiO2是非金属氧化物,它不与任何酸反应 | |
| C. | 可以用焦炭还原二氧化硅生产硅:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑ | |
| D. | 高纯硅可用于制造光导纤维,高纯二氧化硅可用于制造太阳能电池 |
15. 四种短周期元素在周期表中的相对位置如下表所示,其中Z原子最外层电子数是其电子层数的2 倍.元素M与Z同周期,且原子半径是同周期中最大的.元素R是第四周期的过渡元素;R有甲、乙两种常见氢氧化物,其中甲在常温下置于空气中,会由白色变为灰绿色,最后变为红褐色的乙.
四种短周期元素在周期表中的相对位置如下表所示,其中Z原子最外层电子数是其电子层数的2 倍.元素M与Z同周期,且原子半径是同周期中最大的.元素R是第四周期的过渡元素;R有甲、乙两种常见氢氧化物,其中甲在常温下置于空气中,会由白色变为灰绿色,最后变为红褐色的乙.
请按要求回答下列问题:
(1)X的单质的电子式: ;W最高价氧化物的水化物的化学式:HClO4.
;W最高价氧化物的水化物的化学式:HClO4.
(2)M、Z、W分别形成的简单离子的半径由大到小顺序为S2->Cl->Na+(填离子符号);写一个能说明元素W比元素Z的非金属性强的化学方程式:H2S+Cl2=S2↓+2HCl.
(3)甲变为乙的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3.
(4)常温下,当用200mL 1mol•L-1的MOH溶液吸收4.48L(已折算为标准状况)ZY2时,所得溶液的主要溶质(填化学式)为NaHSO3;此时溶液pH<7,则其中含Z元素的几种粒子(忽略ZY2)的浓度由大到小的顺序为c(HSO3-)>c(SO32-)>c(H2SO3).
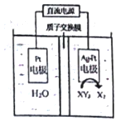
(5)工业上用电化学法治理酸性废液中的XY3-的原理如图示,其阴极的反应式为2NO3-+12H++10e-=N2↑+6H2O.
 四种短周期元素在周期表中的相对位置如下表所示,其中Z原子最外层电子数是其电子层数的2 倍.元素M与Z同周期,且原子半径是同周期中最大的.元素R是第四周期的过渡元素;R有甲、乙两种常见氢氧化物,其中甲在常温下置于空气中,会由白色变为灰绿色,最后变为红褐色的乙.
四种短周期元素在周期表中的相对位置如下表所示,其中Z原子最外层电子数是其电子层数的2 倍.元素M与Z同周期,且原子半径是同周期中最大的.元素R是第四周期的过渡元素;R有甲、乙两种常见氢氧化物,其中甲在常温下置于空气中,会由白色变为灰绿色,最后变为红褐色的乙.| X | Y | |
| Z | W |
(1)X的单质的电子式:
 ;W最高价氧化物的水化物的化学式:HClO4.
;W最高价氧化物的水化物的化学式:HClO4.(2)M、Z、W分别形成的简单离子的半径由大到小顺序为S2->Cl->Na+(填离子符号);写一个能说明元素W比元素Z的非金属性强的化学方程式:H2S+Cl2=S2↓+2HCl.
(3)甲变为乙的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3.
(4)常温下,当用200mL 1mol•L-1的MOH溶液吸收4.48L(已折算为标准状况)ZY2时,所得溶液的主要溶质(填化学式)为NaHSO3;此时溶液pH<7,则其中含Z元素的几种粒子(忽略ZY2)的浓度由大到小的顺序为c(HSO3-)>c(SO32-)>c(H2SO3).
(5)工业上用电化学法治理酸性废液中的XY3-的原理如图示,其阴极的反应式为2NO3-+12H++10e-=N2↑+6H2O.