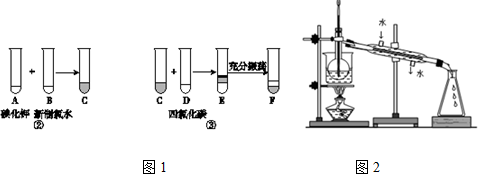
题目内容
20.欲用18.4mol•L-1的浓硫酸配制成浓度为0.5mol•L-1的稀硫酸500ml.(1)选用的仪器有:
①量筒 ②烧杯 ③玻璃棒 ④500mL容量瓶,⑤胶头滴管.
(2)下列各操作正确的顺序为A、E、F、D、C、B.
A.用量筒量取浓H2SO4 B.反复颠倒摇匀 C.用胶头滴管加蒸馏水至刻度线
D.洗涤所用仪器2至3次,洗涤液也转入容量瓶中 E.稀释浓H2SO4 F.将溶液转入容量瓶
(3)简要回答下列问题:
①所需浓硫酸的体积为13.6mL.
②浓硫酸稀释后在转入容量瓶前应恢复至室温,否则会使浓度偏高.
③定容时必须使溶液液面与刻度线相切,若俯视会使浓度偏高.
分析 (1)根据配制一定物质的量浓度的溶液一般步骤选择需要的仪器;
(2)配制一定物质的量浓度溶液的一般步骤为:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶、贴标签,据此排序;
(3)①根据溶液稀释过程中溶质硫酸的物质的量不变计算出需要浓硫酸的体积;
②依据浓硫酸稀释产生大量的热,容量瓶在室温下体积准确结合物体热胀冷缩原理解答;
③俯视刻度线,导致溶液体积偏小,依据C=$\frac{n}{V}$进行误差分析.
解答 解:(1)配制一定物质的量浓度溶液的一般步骤为:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀等用到的仪器:量筒、烧杯、玻璃棒、500mL容量瓶、胶头滴管,
所以还需要的仪器为:500mL容量瓶、玻璃棒;
故答案为:500mL容量瓶 胶头滴管;
(2)制一定物质的量浓度溶液的一般步骤为:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶、贴标签,所以正确的操作顺序为:A、E、F、D、C、B;
故答案为:A、E、F、D、C、B;
(3)①设需要浓硫酸体积为V,则根据溶液稀释过程中溶质硫酸的物质的量不变得:18.4mol/L×V=0.5mol•L-1×500mL,解得V=13.6mL;
故答案为:13.6;
②浓硫酸稀释过程中产生大量的热,要使测量体积准确,则应冷却到室温再移液,否则由于热胀冷原因,定容后,液面下降导致溶液体积偏小,依据C=$\frac{n}{V}$可知溶液浓度偏高;
故答案为:恢复至室温; 高;
③俯视刻度线,导致溶液体积偏小,依据C=$\frac{n}{V}$可知,溶液浓度偏高;
故答案为:高.
点评 本题考查一定物质的量浓度溶液配制过程、物质的量浓度有关计算和误差分析等,明确配制原理是解题关键,注意误差分析的方法.

练习册系列答案
相关题目
12.钴(Co)及其化合物在工业上有广泛应用.为从某工业废料中回收钴,某学生设计流程如图(废料中含Al、Li、Co2O3和Fe2O3等物质)
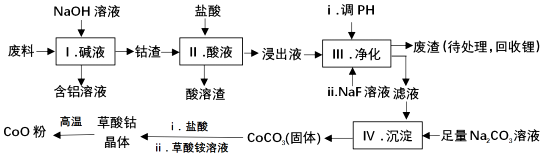
已知:①物质溶解性:LiF难溶于水;LiCO3微溶于水;CoCO3难溶于水
②部分金属离子形成氢氧化物沉淀的pH见表一.
表一:
请回答:
(1)I中得到含铝溶液的反应离子方程式是2Al+2OH-+2H2O=2AlO2-+3H2↑.
(2)I中得到钴渣的实验操作是过滤(填操作名称).
(3)写出步骤Ⅱ中Co2O3与盐酸反应生成Cl2的离子方程式:Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O.
(4)步骤Ⅲ中调节溶液的pH时,pH的范围是3.2≤PH<7.15
(5)废渣中的主要成分有Fe(OH)3,LiF.步骤Ⅲ中加入NaF溶液,对步骤Ⅳ所起的作用是降低溶液中Li+的浓度,避免步骤Ⅳ形成Li2CO3的沉淀.
(6)在空气中加热5.49g草酸钴晶体(CoC2O4•2H2O)样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如表二.已知[M(CoC2O4•2H2O)]=183g/mol
表二:
①加热到210℃时,固体物质的化学式为:CoC2O4
②经测定,加热到210~310℃过程中生成物只有CO2和钴的氧化物,此过程发生反应的化学方程式为:3CoC2O4+2O2$\frac{\underline{\;210~310℃\;}}{\;}$Co3O4+6CO2.

已知:①物质溶解性:LiF难溶于水;LiCO3微溶于水;CoCO3难溶于水
②部分金属离子形成氢氧化物沉淀的pH见表一.
表一:
| Fe3+ | Co2+ | Co3+ | Al3+ | |
| pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
(1)I中得到含铝溶液的反应离子方程式是2Al+2OH-+2H2O=2AlO2-+3H2↑.
(2)I中得到钴渣的实验操作是过滤(填操作名称).
(3)写出步骤Ⅱ中Co2O3与盐酸反应生成Cl2的离子方程式:Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O.
(4)步骤Ⅲ中调节溶液的pH时,pH的范围是3.2≤PH<7.15
(5)废渣中的主要成分有Fe(OH)3,LiF.步骤Ⅲ中加入NaF溶液,对步骤Ⅳ所起的作用是降低溶液中Li+的浓度,避免步骤Ⅳ形成Li2CO3的沉淀.
(6)在空气中加热5.49g草酸钴晶体(CoC2O4•2H2O)样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如表二.已知[M(CoC2O4•2H2O)]=183g/mol
表二:
| 温度范围/℃ | 固体质量/g |
| 150~210 | 4.41 |
| 290~320 | 2.41 |
| 890~920 | 2.25 |
②经测定,加热到210~310℃过程中生成物只有CO2和钴的氧化物,此过程发生反应的化学方程式为:3CoC2O4+2O2$\frac{\underline{\;210~310℃\;}}{\;}$Co3O4+6CO2.
13.Ⅰ和Ⅱ均正确并且有因果关系的是( )
| 选项 | 叙述I | 叙述II |
| A | Na2S有强还原性 | 用于除去废水中的Cu2+和Hg2+ |
| B | 浓H2SO4有强氧化性 | 浓H2SO4可用于干燥SO2 |
| C | NaHCO3溶于水完全电离 | NaHCO3是强电解质 |
| D | Cl2具有酸性 | Cl2可与石灰乳或烧碱反应制备含氯消毒剂 |
| A. | A | B. | B | C. | C | D. | D |
15.某元素原子价电子构型为3d54S2,该元素位于元素周期表的( )
| A. | s区 | B. | p区 | C. | d区 | D. | ds区 |
5.某实验小组拟配制0.10mol•L-1的NaOH溶液并进行有关性质实验,回答下列问题.
(1)若实验中大约要使用475mL NaOH溶液,至少需要称量NaOH固体2.0 g.
(2)从表中选择称量NaOH固体所需要的仪器:abe(填序号).
(3)下列情况会使所配溶液浓度偏低的是①③⑤⑦(填序号).
①称量读数时,左盘高,右盘低
②所用的砝码生锈
③溶液转移到容量瓶后,未进行洗涤操作
④转移溶液前容量瓶内有少量蒸馏水
⑤定容时,仰视容量瓶的刻度线
⑥在烧杯中溶解NaOH后,立即将所得溶液注入容量瓶中
⑦定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线.
(1)若实验中大约要使用475mL NaOH溶液,至少需要称量NaOH固体2.0 g.
(2)从表中选择称量NaOH固体所需要的仪器:abe(填序号).
| 名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  |  |  |  |  |
| 序号 | a | b | c | d | e | f |
①称量读数时,左盘高,右盘低
②所用的砝码生锈
③溶液转移到容量瓶后,未进行洗涤操作
④转移溶液前容量瓶内有少量蒸馏水
⑤定容时,仰视容量瓶的刻度线
⑥在烧杯中溶解NaOH后,立即将所得溶液注入容量瓶中
⑦定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线.
10.硅及其化合物是带来人类文明的重要物质.下列说法正确的是( )
| A. | 陶瓷、水晶、水泥、玻璃都属于硅酸盐 | |
| B. | SiO2是非金属氧化物,它不与任何酸反应 | |
| C. | 可以用焦炭还原二氧化硅生产硅:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑ | |
| D. | 高纯硅可用于制造光导纤维,高纯二氧化硅可用于制造太阳能电池 |