题目内容
14.今有一混合物的水溶液,可能含有以下离子中的若干种:K+、NH4+、Mg2+、Ba2+、Cl-、CO32-、SO42-,现取两份100mL溶液分别进行如下实验:(1)加入AgNO3溶液有沉淀产生;(2)加足量BaCl2溶液,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g.根据上述实验,以下推测正确的是( )| A. | NH4+可能存在 | |
| B. | 若焰色反应测得K+存在,则NH4+不一定存在 | |
| C. | Cl-不可能存在 | |
| D. | Ba2+一定不存在,Mg2+可能存在 |
分析 根据题意分析,第一份溶液加入AgNO3溶液有沉淀产生,推得可能含有Cl-、CO32-、SO42-;第二份溶液利用发生的离子反应,经过计算、推得一定存在CO32-、SO42-,一定不存在Ba2+,根据电中性原理,一定存在钾离子和铵根离子中的至少一种,Cl-无法判断是否存在.
解答 解:根据题意,Ba2+和SO42-,可发生离子反应生成BaSO4↓,因此两者不能共存.Ba2+和CO32-可发生离子反应生成BaCO3↓,因此两者也不能共存.
第一份加入AgNO3溶液有沉淀产生,可能发生Cl-+Ag+═AgCl↓、CO32-+2Ag+═Ag2CO3↓、SO42-+2Ag+═Ag2SO4↓,所以可能含有Cl-、CO32-、SO42-,一定不存在Mg2+.第二份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤.干燥后,沉淀质量为2.33g.部分沉淀溶于盐酸为
BaCO3,部分沉淀不溶于盐酸为BaSO4,发生反应CO32-+Ba2+═BaCO3↓、SO42-+Ba2+═BaSO4↓,
因为BaCO3+2HCl═BaCl2+CO2↑+H2O而使BaCO3溶解.因此溶液中一定存在CO32-、SO42-,一定不存在Ba2+.
由条件可知BaSO4为2.33g,物质的量为0.01mol,BaCO3为6.27g-2.33g═3.94g,物质的量为0.02mol.
则CO32-物质的量为0.02mol,由上述分析可得,溶液中一定存在CO32-、SO42-,一定不存在Mg2+、Ba2+.根据电中性原理,一定存在钾离子和铵根离子中的至少一种.
A、溶液中一定存在CO32-、SO42-,一定不存在Mg2+、Ba2+.根据电中性原理,一定存在钾离子和铵根离子中的至少一种,NH4+可能存在,故A正确;
B、一定存在钾离子和铵根离子中的至少一种,若焰色反应测得K+存在,NH4+可能也存在,故B正确;
C、Cl-无法判断是否存在,故C错误;
D、一定不存在Mg2+、Ba2+,故D错误.
故选AB.
点评 本题考查离子的检验,采用定性实验和定量计算分析相结合的模式,增大了解题难度,同时涉及离子共存、离子反应等都是解题需注意的信息,尤其是K+的确定易出现失误.

 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案| A. | 所含硫原子数目之比是 5:4 | B. | 氧原子的物质的量之比为 3:2 | ||
| C. | 氧元素的质量之比为 6:5 | D. | 硫元素的质量之比为 4:5 |
 某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.
某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)?2NH3(g)+CO2(g).实验测得不同温度下的平衡数据列于如表:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度 (×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
A.2v(NH3)═v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
②根据表中数据,列式计算25.0℃时氨基甲酸铵的分解平衡常数1.6×10-8;
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25℃下达到分解平衡.若在恒温下压缩容器体积,氨基甲酸铵固体的质量增加(填“增加”、“减小”或“不变”);
④氨基甲酸铵分解反应的焓变△H>0;
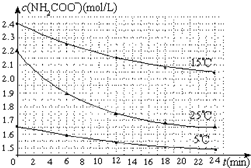
(2)已知:NH2COONH4+2H2O?NH4HCO3+NH3•H2O.该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示.
⑤计算25℃时,0~6min氨基甲酸铵水解反应的平均速率0.05mol/(L•min);
⑥根据图中信息,如何说明水解反应速率随温度升高而增大25℃反应物起始浓度较小,但0~6min的平均反应速率(曲线的斜率)仍比15℃大.
 氧元素和卤族元素都能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解.
氧元素和卤族元素都能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解.(1)COCl2 的空间构型为平面三角形;溴的基态原子价电子排布式为4s24p5.
(2)已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列A式发生(填字母代号,下同).
A.CsICl2═CsCl+ICl B.CsICl2═CsI+Cl2?
(3)根据下表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是碘(或I).
| 氟 | 氯 | 溴 | 碘 | |
(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
A.HCl B.HF C.SO2 D.SCl2
(5)已知ClO2-为三角形,中心氯原子周围有四对价层电子.ClO3- 中心氯原子的杂化轨道类型为sp3杂化,写出一个与CN-互为等电子体的物质的分子式N2或CO.
(6)钙在氧气中燃烧时得到一种钙的氧化物晶体,其结构如图所示,由此可判断钙的氧化物的化学式为CaO2.已知该氧化物的密度是ρ g/cm3,则晶胞内离得最近的两个钙离子的间距为$\frac{\sqrt{2}}{2}×\root{3}{\frac{72×4}{ρ{N}_{A}}}$cm(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA).
| A. | 乙醇和乙酸都是常用调味品的主要成分 | |
| B. | 通过红外光谱分析可以区分乙醇与乙酸乙酯 | |
| C. | 溴丙烷水解制丙醇与丙烯和水反应制丙醇属于不同反应类型 | |
| D. | 乙醇和乙酸之间能发生酯化反应,酯化反应和皂化反应互为逆反应 |
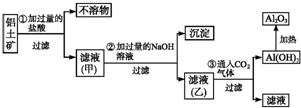 工业上用铝土矿(主要成分SiO2、Al2O3、Fe3O4)提取氧化铝作冶炼铝的原料,提取的操作过程如图所示:
工业上用铝土矿(主要成分SiO2、Al2O3、Fe3O4)提取氧化铝作冶炼铝的原料,提取的操作过程如图所示: