题目内容
关于Ca(钙)元素的叙述正确的是( )
| A、位于元素周期表中短周期 |
| B、原子最外层有1个电子 |
| C、属于金属元素,和Na同属于ⅠA族 |
| D、能和水反应,生成氢气 |
考点:元素周期律和元素周期表的综合应用,位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:Ca元素的原子序数为20,处于元素周期表中第四周期第ⅡA族,有4个电子层,最外层电子数为2,容易失去电子,表现出较强的还原性,能与水反应生成氢气,据此分析选择即可.
解答:
解:A、Ca元素的原子序数为20,处于元素周期表中第四周期,属于长周期元素,故A错误;
B、Ca原子核外电子排布为: ,即核外最外层有2个电子,故B错误;
,即核外最外层有2个电子,故B错误;
C、Ca属于金属元素,属于ⅡA族,不与Na同主族,故C错误;
D、Ca原子最外层的两个电子容易失去,故较活泼,能与水反应生成氢气,故D正确,
故选D.
B、Ca原子核外电子排布为:
 ,即核外最外层有2个电子,故B错误;
,即核外最外层有2个电子,故B错误;C、Ca属于金属元素,属于ⅡA族,不与Na同主族,故C错误;
D、Ca原子最外层的两个电子容易失去,故较活泼,能与水反应生成氢气,故D正确,
故选D.
点评:本题主要考查的是元素的位置、结构与性质的关系,熟练掌握元素周期表是关键,属于基础题.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
钾长石的主要成分为硅酸盐,由前20号元素中的四种组成,化学式为XYZ3W8,其中只有W显负价.X、Y的最外层电子数之和与Z的最高正价数相等,Y3+与W的阴离子具有相同的电子层结构,X、W的质子数之和等于Y、Z的质子数之和.下列说法错误的是( )
| A、X的离子半径>Y的离子半径 |
| B、Z的氢化物稳定性>W的氢化物稳定性 |
| C、化合物X2W2和Y2W3中都不含配位键 |
| D、1mol ZW2晶体所含Z-W键的数目为4NA |
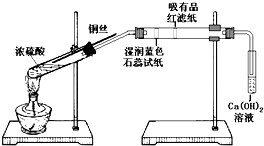 某同学利用如图装置进行浓硫酸和铜反应并验证二氧化硫的性质.按如图实验装置连接仪器和放置药品.加热浓硫酸约1分钟后撤去酒精灯,将铜丝插入液面,反应一段时间后拔出.实验结束后会看到两个试管的液体底部均有少量的白色固体.下列对该实验的现象分析或推断正确的是( )
某同学利用如图装置进行浓硫酸和铜反应并验证二氧化硫的性质.按如图实验装置连接仪器和放置药品.加热浓硫酸约1分钟后撤去酒精灯,将铜丝插入液面,反应一段时间后拔出.实验结束后会看到两个试管的液体底部均有少量的白色固体.下列对该实验的现象分析或推断正确的是( )| A、湿润的蓝色石蕊试纸先变红后褪色 |
| B、左边试管出现的白色固体是由于浓硫酸的脱水性所致 |
| C、从该实验的描述中可以体会出铜与浓硫酸的反应是一个放热反应 |
| D、本实验体现出了二氧化硫的酸性、漂白性和弱氧化性 |
短周期元素A、B、C、D的原子序数依次递增,它们的核电荷数之和为32,原子最外层电子数之和为10,A与C同主族,B与D同主族,A、C原子的最外层电子数之和等于B原子的次外层电子数.则下列叙述正确的是( )
| A、D元素处于元素周期表中第3周期第Ⅳ族 |
| B、B与D形成的化合物中,每个原子的最外层电子均为8个电子 |
| C、B、D的最高价氧化物中,D的最高价氧化物熔沸点高的根本原因在于D的最高价氧化物相对分子质量比B的最高价氧化物高 |
| D、A与D形成的化合物是一种稳定性较差的非极性分子 |
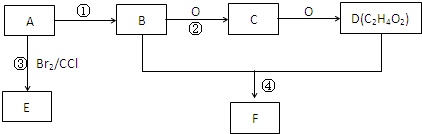
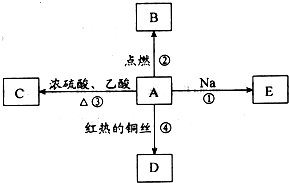 ⅠA是化学实验室中最常见的有机物,它易溶于水并有特殊香味,并能进行如图所示的多种反应.
ⅠA是化学实验室中最常见的有机物,它易溶于水并有特殊香味,并能进行如图所示的多种反应.