题目内容
A、B、C为三种短周期元素,核电荷数依次增大,且A、B、C三种元素的原子核外电子层数之和为5.已知A是原子结构最简单的元素,B元素原子最外层上的电子数是其电子层数的2倍,A和C之间可形成A2C和A2C2两种化合物.请回答下列问题.
(1)C元素在元素周期表中的位置是 ;A、B、C的元素符号是:A ,B ,C
(2)用电子式表示化合物BC2的形成过程 .
(3)在恒温下,体积为2L的恒容容器中加入一定量的B单质和1molA2C蒸汽,发生:B(s)+A2C(g)?BC(g)+A2(g).2min后,容器的压强增加了20%,则2min内A2C的反应速率为 .一段时间后达到平衡,下列说法正确的是
A.增加B单质的量,反应速率加快
B.恒温恒容时在该容器中通入Ar,反应速率加快
C.气体的密度不再变化可以判断该反应达到了平衡
D.2min时,A2C的转化率为80%
E.气体的平均摩尔质量不变时,该反应达到平衡
(4)BC与C2在碱性条件下可形成一种燃料电池.该电池的负极反应式为 .
(1)C元素在元素周期表中的位置是
(2)用电子式表示化合物BC2的形成过程
(3)在恒温下,体积为2L的恒容容器中加入一定量的B单质和1molA2C蒸汽,发生:B(s)+A2C(g)?BC(g)+A2(g).2min后,容器的压强增加了20%,则2min内A2C的反应速率为
A.增加B单质的量,反应速率加快
B.恒温恒容时在该容器中通入Ar,反应速率加快
C.气体的密度不再变化可以判断该反应达到了平衡
D.2min时,A2C的转化率为80%
E.气体的平均摩尔质量不变时,该反应达到平衡
(4)BC与C2在碱性条件下可形成一种燃料电池.该电池的负极反应式为
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:三种短周期元素A、B、C的原子序数依次增大,A是原子结构最简单的元素,故A为氢,属于第一周期,B元素原子最外层上的电子数是其电子层数的2倍,则B原子有2个电子层,最外层电子数为4,则B为碳元素,属于第二周期;A、B、C三种元素的原子核外电子层数之和为5,故C为第二周期元素,A和C之间可形成A2C和A2C2两种化合物,故C为氧元素,据此解答即可.
解答:
解:三种短周期元素A、B、C的原子序数依次增大,A是原子结构最简单的元素,故A为氢,属于第一周期,B元素原子最外层上的电子数是其电子层数的2倍,则B原子有2个电子层,最外层电子数为4,则B为碳元素,属于第二周期;A、B、C三种元素的原子核外电子层数之和为5,故C为第二周期元素,A和C之间可形成A2C和A2C2两种化合物,故C为氧元素,
综上所述,A为氢,B为碳,C为氧,
(1)C为氧元素,O在元素周期表中的位置是第二周期第VIA族,氢、碳、氧的元素符号分别为:H、C、O,故答案为:第二周期第VIA族;H;C;O;
(2)BC2为CO2,二氧化碳为共价化合物,碳与氧之间形成两对共价键,二氧化碳的形成过程为: ,
,
故答案为: ;
;
(3)C(s)+H2O(g)?CO(g)+H2(g),
开始 1 0 0
转化 a a a
平衡 1-a a a
2min后,容器的压强增加了20%,即
=
,解a=0.2,故2min内H2O的反应速率为:v=
=
=0.05mol/(L?min),
A.增加固体单质的量,不会影响化学反应速率,故A错误;
B.恒温恒容时在该容器中通入Ar,加入Ar,不改变反应中各种物质的浓度,故化学反应速率不变,故B错误;
C.气体的密度ρ=
,反应过程中,m变大,V不变,故正反应方向ρ变大,若不再变化可以判断该反应达到了平衡,故C正确;
D.2min时,H2O的转化率为
×100=20%,故D错误;
E.气体的平均摩尔质量M=
,正反应方向,m增大,n增大,故M变化,若M不变时,该反应达到平衡,故E正确,故选CE,
故答案为:0.05mol/(L?min);CE;
(4)CO燃烧生成二氧化碳,二氧化碳与碱反应生成碳酸根,故燃料电池的负极反应为:CO+4OH--2e-=CO32-+2H2O,故答案为:CO+4OH--2e-=CO32-+2H2O.
综上所述,A为氢,B为碳,C为氧,
(1)C为氧元素,O在元素周期表中的位置是第二周期第VIA族,氢、碳、氧的元素符号分别为:H、C、O,故答案为:第二周期第VIA族;H;C;O;
(2)BC2为CO2,二氧化碳为共价化合物,碳与氧之间形成两对共价键,二氧化碳的形成过程为:
 ,
,故答案为:
 ;
;(3)C(s)+H2O(g)?CO(g)+H2(g),
开始 1 0 0
转化 a a a
平衡 1-a a a
2min后,容器的压强增加了20%,即
| 1 |
| 1+20% |
| 1 |
| 1-a+a+a |
| △c |
| △t |
| ||
| 2min |
A.增加固体单质的量,不会影响化学反应速率,故A错误;
B.恒温恒容时在该容器中通入Ar,加入Ar,不改变反应中各种物质的浓度,故化学反应速率不变,故B错误;
C.气体的密度ρ=
| m |
| V |
D.2min时,H2O的转化率为
| 0.2mol |
| 1mol |
E.气体的平均摩尔质量M=
| m |
| n |
故答案为:0.05mol/(L?min);CE;
(4)CO燃烧生成二氧化碳,二氧化碳与碱反应生成碳酸根,故燃料电池的负极反应为:CO+4OH--2e-=CO32-+2H2O,故答案为:CO+4OH--2e-=CO32-+2H2O.
点评:本题主要考查的是元素的推断以及化学反应平衡原理,属于中等难度的题目,注意总结.

练习册系列答案
相关题目
在100mL某混合溶液中,c(HNO3)=0.2mol?L-1,c(H2SO4)=0.1mol?L-1,向其中加入1.92g Cu粉,微热充分反应后溶液中的c(Cu2+)为( )
| A、0.15 mol?L-1 |
| B、0.3 mol?L-1 |
| C、0.225 mol?L-1 |
| D、无法计算 |
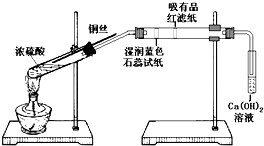 某同学利用如图装置进行浓硫酸和铜反应并验证二氧化硫的性质.按如图实验装置连接仪器和放置药品.加热浓硫酸约1分钟后撤去酒精灯,将铜丝插入液面,反应一段时间后拔出.实验结束后会看到两个试管的液体底部均有少量的白色固体.下列对该实验的现象分析或推断正确的是( )
某同学利用如图装置进行浓硫酸和铜反应并验证二氧化硫的性质.按如图实验装置连接仪器和放置药品.加热浓硫酸约1分钟后撤去酒精灯,将铜丝插入液面,反应一段时间后拔出.实验结束后会看到两个试管的液体底部均有少量的白色固体.下列对该实验的现象分析或推断正确的是( )| A、湿润的蓝色石蕊试纸先变红后褪色 |
| B、左边试管出现的白色固体是由于浓硫酸的脱水性所致 |
| C、从该实验的描述中可以体会出铜与浓硫酸的反应是一个放热反应 |
| D、本实验体现出了二氧化硫的酸性、漂白性和弱氧化性 |
短周期元素A、B、C、D的原子序数依次递增,它们的核电荷数之和为32,原子最外层电子数之和为10,A与C同主族,B与D同主族,A、C原子的最外层电子数之和等于B原子的次外层电子数.则下列叙述正确的是( )
| A、D元素处于元素周期表中第3周期第Ⅳ族 |
| B、B与D形成的化合物中,每个原子的最外层电子均为8个电子 |
| C、B、D的最高价氧化物中,D的最高价氧化物熔沸点高的根本原因在于D的最高价氧化物相对分子质量比B的最高价氧化物高 |
| D、A与D形成的化合物是一种稳定性较差的非极性分子 |
0.1mol某金属单质与足量的盐酸反应,放出1.12L H2(标准状况),并转变为具有Ar原子的电子层结构的离子,该金属元素在元素周期表中的位置是( )
| A、第三周期第IA族 |
| B、第四周期第IA族 |
| C、第三周期第ⅡA族 |
| D、第四周期第ⅡA族 |
下列有关Fe(OH)3胶体的说法正确的是( )
| A、用渗析法鉴别Fe(OH)3胶体和FeCl3溶液,用丁达尔效应分离Fe(OH)3胶体和FeCl3溶液 |
| B、Fe(OH)3胶体微粒带负电荷,在通电的情况下胶体微粒向直流电源的正极移动,这种现象称为电泳 |
| C、向沸腾的蒸馏水中逐滴滴加饱和FeCl3溶液,至液体呈透明的红褐色时即得到Fe(OH)3胶体 |
| D、向沸腾的NaOH稀溶液中边滴加FeCl3饱和溶液,边用玻璃棒搅拌,然后继续煮沸制备Fe(OH)3胶体 |
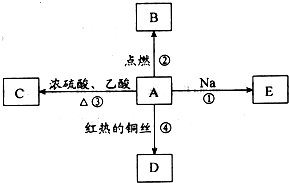 ⅠA是化学实验室中最常见的有机物,它易溶于水并有特殊香味,并能进行如图所示的多种反应.
ⅠA是化学实验室中最常见的有机物,它易溶于水并有特殊香味,并能进行如图所示的多种反应.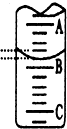 我国规定饮用水的硬度不能超过25度.硬度的表示方法是:将水中的Ca2+和Mg2+都看作Ca2+,并将其折算成CaO的质量.通常把1升水中含有10mg CaO称为1度.某化学实验小组对本地区地下水的硬度进行检测,实验过程如下:
我国规定饮用水的硬度不能超过25度.硬度的表示方法是:将水中的Ca2+和Mg2+都看作Ca2+,并将其折算成CaO的质量.通常把1升水中含有10mg CaO称为1度.某化学实验小组对本地区地下水的硬度进行检测,实验过程如下: