题目内容
下列图式表示正确的是( )
A、二氧化碳 |
| B、次氯酸的结构式 H-Cl-O |
| C、铁离子的价电子排布式 3d34s2 |
D、氯化铯的晶体结构  |
考点:电子式、化学式或化学符号及名称的综合
专题:化学用语专题
分析:A、二氧化碳中存在两个碳氧双键,不存在碳氧单键;
B、次氯酸的结构式为H-O-Cl,次氯酸中不存在氢氯键;
C、铁元素是26号元素,铁原子核外有26个电子,铁原子失去3个电子变成铁离子,根据构造原理判断其价电子排布式;
D、利用氯化铯与氯化钠都是体心立方晶体结构.
B、次氯酸的结构式为H-O-Cl,次氯酸中不存在氢氯键;
C、铁元素是26号元素,铁原子核外有26个电子,铁原子失去3个电子变成铁离子,根据构造原理判断其价电子排布式;
D、利用氯化铯与氯化钠都是体心立方晶体结构.
解答:
解:A、二氧化碳中存在两个碳氧双键,碳原子和氧原子最外层都达到8电子稳定结构,二氧化碳正确的电子式为 ,故A错误;
,故A错误;
B、结构式的书写时原子的排列方式为:化合价绝对值大放中间,小的放周边,其结构式为H-O-Cl,故B错误;
C、铁元素是26号元素,其原子核外有26个电子,铁原子失去3个电子变成铁离子,铁离子的价电子排布式为3d5,故C错误;
D、氯化铯晶胞是体心立方晶胞,配位数为8,氯化铯的晶体结构为 故D正确;
故D正确;
故选D.
 ,故A错误;
,故A错误;B、结构式的书写时原子的排列方式为:化合价绝对值大放中间,小的放周边,其结构式为H-O-Cl,故B错误;
C、铁元素是26号元素,其原子核外有26个电子,铁原子失去3个电子变成铁离子,铁离子的价电子排布式为3d5,故C错误;
D、氯化铯晶胞是体心立方晶胞,配位数为8,氯化铯的晶体结构为
 故D正确;
故D正确;故选D.
点评:本题考查常见化学用语的书写判断,题目难度中等,试题侧重基础知识的考查、综合性较强,注意掌握电子式、结构式、电子排布式等化学用语的概念及表示方法,选项D为易错点,注意明确氯化铯的晶体结构.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
在反应H2S+H2SO4═S↓+SO2↑+2H2O中,若有32g硫生成,则转移电子为( )
| A、6 mol |
| B、3 mol |
| C、2 mol |
| D、4 mol |
能说明X的非金属性比Y的强的是( )
| A、X的最高价氧化物的水化物的碱性比Y的最高价氧化物的水化物的碱性强 |
| B、X的最高价氧化物的水化物的酸性比Y的最高价氧化物的水化物的酸性强 |
| C、与H2化合时X单质不如Y单质容易 |
| D、Y单质可以X把从其氢化物中置换出来 |
下列说法正确的是( )
| A、CO2的摩尔质量为44g |
| B、5.4mL4℃的H2O中,约含有1.806×1023个水分子 |
| C、标准状况下,2.24L CCl4所含的原子数为0.5NA |
| D、1mol?L-1的Na2SO4溶液中,含Na+的个数为2NA |
在100mL某混合溶液中,c(HNO3)=0.2mol?L-1,c(H2SO4)=0.1mol?L-1,向其中加入1.92g Cu粉,微热充分反应后溶液中的c(Cu2+)为( )
| A、0.15 mol?L-1 |
| B、0.3 mol?L-1 |
| C、0.225 mol?L-1 |
| D、无法计算 |
下列物质按纯净物、混合物、电解质、非电解质的顺序组合的一组为( )
| A、蒸馏水、氨水、氢氧化钡、二氧化硫 |
| B、纯盐酸、空气、硫酸、干冰 |
| C、胆矾、盐酸、铁、碳酸钙 |
| D、氧化钙、漂白粉、氧化铝、碳酸钠 |
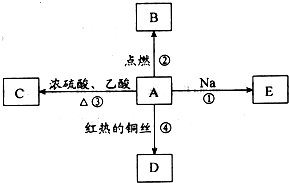 ⅠA是化学实验室中最常见的有机物,它易溶于水并有特殊香味,并能进行如图所示的多种反应.
ⅠA是化学实验室中最常见的有机物,它易溶于水并有特殊香味,并能进行如图所示的多种反应.