题目内容
X、Y、Z、W为短周期的四种元素,其最高正价依次为+1、+3、+5、+7,核电荷数按照Z、X、Y、W的顺序增大.已知Z的原子次外层的电子数为2,W、X原子次外层电子数为8.
(1)元素W在周期表中的位置: .
(2)Z的氢化物和W的氢化物反应方程式 现象 .
(3)X、Y、Z、W的原子半径由大到小的顺序为 .(用元素符号表示)
(4)元素X与元素Y相比,金属性较强的是 (用元素符号表示),请举一例实验事实证明这一结论: .
(1)元素W在周期表中的位置:
(2)Z的氢化物和W的氢化物反应方程式
(3)X、Y、Z、W的原子半径由大到小的顺序为
(4)元素X与元素Y相比,金属性较强的是
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:X、Y、Z、W为短周期的四种元素,其最高正价依次为+1、+3、+5、+7,则分别位于第ⅠA族、ⅢA族、ⅤA族、ⅧA族,核电荷数按照Z、X、Y、W的顺序增大.已知Z的原子次外层的电子数为2,则Z为N元素,W、X原子次外层电子数为8,分别为Cl元素、Na元素,则Y为Al元素,据此答题.
解答:
解:X、Y、Z、W为短周期的四种元素,其最高正价依次为+1、+3、+5、+7,则分别位于第ⅠA族、ⅢA族、ⅤA族、ⅧA族,核电荷数按照Z、X、Y、W的顺序增大.已知Z的原子次外层的电子数为2,则Z为N元素,W、X原子次外层电子数为8,分别为Cl元素、Na元素,则Y为Al元素,
(1)W为Cl元素,原子核外有3个电子层,最外层电子数为7,位于周期表第三周期、ⅥⅠA族,
故答案为:第三周期、ⅥⅠA族;
(2)Z的氢化物为氨气,W的氢化物为氯化氢,它们反应的化学方程式为NH3+HCl=NH4Cl,反应时可观察到有白烟生成,
故答案为:NH3+HCl=NH4Cl;有白烟生成;
(3)X、Y、Z、W分别为:Na、Al、N、Cl,根据同周期元素从左到右原子半径逐渐减小,原子核外电子层数越多半径越大可知:Na>Al>Cl>N,
故答案为:Na>Al>Cl>N;
(4)Na与Al相比较,金属性较强的为Na,因为钠与水反应时要比铝与水反应的程度剧烈,
故答案为:Na;钠与水反应比铝要剧烈.
(1)W为Cl元素,原子核外有3个电子层,最外层电子数为7,位于周期表第三周期、ⅥⅠA族,
故答案为:第三周期、ⅥⅠA族;
(2)Z的氢化物为氨气,W的氢化物为氯化氢,它们反应的化学方程式为NH3+HCl=NH4Cl,反应时可观察到有白烟生成,
故答案为:NH3+HCl=NH4Cl;有白烟生成;
(3)X、Y、Z、W分别为:Na、Al、N、Cl,根据同周期元素从左到右原子半径逐渐减小,原子核外电子层数越多半径越大可知:Na>Al>Cl>N,
故答案为:Na>Al>Cl>N;
(4)Na与Al相比较,金属性较强的为Na,因为钠与水反应时要比铝与水反应的程度剧烈,
故答案为:Na;钠与水反应比铝要剧烈.
点评:本题考查元素周期表和周期律知识,题目难度中等,注意正确推断元素的种类为解答该题的关键.

练习册系列答案
相关题目
下列物质按纯净物、混合物、电解质、非电解质的顺序组合的一组为( )
| A、蒸馏水、氨水、氢氧化钡、二氧化硫 |
| B、纯盐酸、空气、硫酸、干冰 |
| C、胆矾、盐酸、铁、碳酸钙 |
| D、氧化钙、漂白粉、氧化铝、碳酸钠 |
0.1mol某金属单质与足量的盐酸反应,放出1.12L H2(标准状况),并转变为具有Ar原子的电子层结构的离子,该金属元素在元素周期表中的位置是( )
| A、第三周期第IA族 |
| B、第四周期第IA族 |
| C、第三周期第ⅡA族 |
| D、第四周期第ⅡA族 |
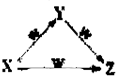 X、Y、Z、W四种物质之间有如图所示的转化关系(部分物质未写全),则X、Y可能是( )
X、Y、Z、W四种物质之间有如图所示的转化关系(部分物质未写全),则X、Y可能是( )①C、CO ②AlCl2、Al(OH)3 ③Fe、Fe(NO3)2 ④NaCO3、NaHCO3.
| A、①②③④ | B、①②④ |
| C、③④ | D、①②③ |
下列实验操作正确的是( )
| A、取出试剂瓶中的Na2CO3溶液,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中 |
| B、将含有Ba(NO3)2的废液倒入水槽中,再用水冲入下水道 |
| C、制取NaCl晶体时,将蒸发皿中NaCl溶液全部加热蒸干 |
| D、用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,冷却至室温才能转移到容量瓶中 |
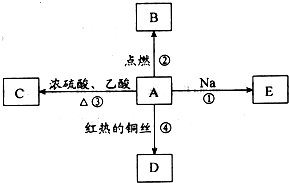 ⅠA是化学实验室中最常见的有机物,它易溶于水并有特殊香味,并能进行如图所示的多种反应.
ⅠA是化学实验室中最常见的有机物,它易溶于水并有特殊香味,并能进行如图所示的多种反应. 我国规定饮用水的硬度不能超过25度.硬度的表示方法是:将水中的Ca2+和Mg2+都看作Ca2+,并将其折算成CaO的质量.通常把1升水中含有10mg CaO称为1度.某化学实验小组对本地区地下水的硬度进行检测,实验过程如下:
我国规定饮用水的硬度不能超过25度.硬度的表示方法是:将水中的Ca2+和Mg2+都看作Ca2+,并将其折算成CaO的质量.通常把1升水中含有10mg CaO称为1度.某化学实验小组对本地区地下水的硬度进行检测,实验过程如下: