题目内容
下列说法中正确的是.
| A、1molH2SO4与1molBa(OH)2完全中和所放出的热量为中和热 |
| B、中和反应都是放热反应 |
| C、氢气燃烧放出大量的热,说明参加反应的氢气和氧气总能量比生成物水的总能量高 |
| D、CO燃烧是吸热反应 |
考点:中和热,化学反应的能量变化规律,吸热反应和放热反应
专题:
分析:A.根据中和热的概念分析;
B.中和反应属于放热反应;
C.反应物总能量高于生成物,反应放热;
D.所有燃烧反应都是放热反应;
B.中和反应属于放热反应;
C.反应物总能量高于生成物,反应放热;
D.所有燃烧反应都是放热反应;
解答:
解:A.中和热是指在稀溶液中强酸和强碱反应生成1mol水放出的热量,所以1molH2SO4和1molBa(OH)2完全反应生成2mol水,不是中和热,故A错误;
B.酸碱发生中和反应时会放出热量,所有的中和反应都是放热反应,故B正确;
C.反应是放热反应,依据反应前后能量守恒得到,反应物总能量高于生成物,故C正确;
D.所有燃烧反应都是放热反应,即CO燃烧是放热反应,故D错误;
故选BC.
B.酸碱发生中和反应时会放出热量,所有的中和反应都是放热反应,故B正确;
C.反应是放热反应,依据反应前后能量守恒得到,反应物总能量高于生成物,故C正确;
D.所有燃烧反应都是放热反应,即CO燃烧是放热反应,故D错误;
故选BC.
点评:本题考查了中和热的概念、能量转化的形式等问题,难度不大,这需要平时多总结,多记忆.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案
相关题目
以0.10mol/L的氢氧化钠溶液滴定某一元弱酸的滴定曲线如图所示.横轴为加入氢氧化钠的体积数,纵轴为溶液的pH.下列正确的是( )


| A、此一元弱酸的电离常数(Ka)约为1.0×10-6 |
| B、此弱酸的浓度为1×10-4mol/L |
| C、此实验最好选用甲基红(变色范围在4.2~6.3)作指示剂 |
| D、此滴定反应为吸热反应 |
利用红外光谱对有机化合物分子进行测试并记录,可初步判断该有机物分子拥有的( )
| A、同分异构体数 |
| B、原子个数 |
| C、官能团种类 |
| D、共价键种类 |
下列有机物的一氯代物种类数的比较,正确的是( )


| A、②>③=①>④ |
| B、②>③>①>④ |
| C、①=②=③=④ |
| D、③=④>①=② |


 是没食子酸的球棍模型,请结合有机结构特征,写出没食子酸的结构简式
是没食子酸的球棍模型,请结合有机结构特征,写出没食子酸的结构简式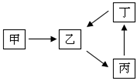 甲、乙、丙、丁四种物质转化关系如右图.已知甲是一种导致钢铁生锈及许多还原性物质变质的单质,化合物乙、丙、丁均含有第三周期一种相同元素R.
甲、乙、丙、丁四种物质转化关系如右图.已知甲是一种导致钢铁生锈及许多还原性物质变质的单质,化合物乙、丙、丁均含有第三周期一种相同元素R.