题目内容
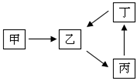 甲、乙、丙、丁四种物质转化关系如右图.已知甲是一种导致钢铁生锈及许多还原性物质变质的单质,化合物乙、丙、丁均含有第三周期一种相同元素R.
甲、乙、丙、丁四种物质转化关系如右图.已知甲是一种导致钢铁生锈及许多还原性物质变质的单质,化合物乙、丙、丁均含有第三周期一种相同元素R.(1)钢铁因甲而生锈时的正极反应式为
(2)若乙是难溶于水的酸性氧化物.则
①R的原子结构示意图
②乙的一种重要用途是
(3)若丙是离子化合物,且阴离子含金属元素R.
①工业上由乙制取R的单质伴随的能量主要转化形式是:
②R的单质与MnO2反应的化学方程式为
③染料工业排放的废水中含有大量有毒的NO2?,可以在碱性条件下加入R的单质除去(加热处理后的废水,会产生能使湿润的红色石蕊试纸变蓝的气体).除去NO2?(有丙的阴离子生成)的离子方程式为
考点:无机物的推断
专题:推断题
分析:甲是一种导致钢铁生锈及许多还原性物质变质的单质,则甲为O2,化合物乙、丙、丁均含有第三周期一种相同元素R.
(1)钢铁因甲而生锈时,正极上发生还原反应,氧气在正极获得电子生成氢氧根离子;
(2)若乙是难溶于水的酸性氧化物,则乙为SiO2,结合转化关系可知,丙为可溶性硅酸盐、丁为H2SiO3;
(3)若丙是离子化合物,且阴离子含金属元素R,则丙为偏铝酸盐,R为Al元素,由转化关系可知,乙为Al2O3,丁为Al(OH)3.
(1)钢铁因甲而生锈时,正极上发生还原反应,氧气在正极获得电子生成氢氧根离子;
(2)若乙是难溶于水的酸性氧化物,则乙为SiO2,结合转化关系可知,丙为可溶性硅酸盐、丁为H2SiO3;
(3)若丙是离子化合物,且阴离子含金属元素R,则丙为偏铝酸盐,R为Al元素,由转化关系可知,乙为Al2O3,丁为Al(OH)3.
解答:
解:甲是一种导致钢铁生锈及许多还原性物质变质的单质,则甲为O2,化合物乙、丙、丁均含有第三周期一种相同元素R.
(1)钢铁因甲而生锈时,正极上发生还原反应,氧气在正极获得电子生成氢氧根离子,正极电极反应式为:2H2O+4e-+O2=4OH-,
故答案为:2H2O+4e-+O2=4OH-;
(2)若乙是难溶于水的酸性氧化物,则乙为SiO2,结合转化关系可知,丙为可溶性硅酸盐、丁为H2SiO3,则:①R为Si元素,原子结构示意图为 ,②乙为二氧化硅,可以制造光导纤维或生产玻璃等,
,②乙为二氧化硅,可以制造光导纤维或生产玻璃等,
故答案为: ;制造光导纤维或生产玻璃等;
;制造光导纤维或生产玻璃等;
(3)若丙是离子化合物,且阴离子含金属元素R,则丙为偏铝酸盐,R为Al元素,由转化关系可知,乙为Al2O3,丁为Al(OH)3,则:
①工业上电解熔融的氧化铝冶炼Al,则制取Al的单质伴随的能量主要转化形式是:电能转化为化学能,
故答案为:电;化学;
②Al的单质与MnO2反应的化学方程式为:4Al+3MnO2
2Al2O3+3Mn,
故答案为:4Al+3MnO2
2Al2O3+3Mn;
③染料工业排放的废水中含有大量有毒的NO2-,可以在碱性条件下加入Al的单质除去,加热处理后的废水,会产生能使湿润的红色石蕊试纸变蓝的气体,生成氨气,有丙的阴离子生成,即还生成偏铝酸根,该反应的离子方程式为:2Al+OH-+NO2-+2H2O=2AlO2-+NH3.H2O,
故答案为:2Al+OH-+NO2-+2H2O=2AlO2-+NH3.H2O.
(1)钢铁因甲而生锈时,正极上发生还原反应,氧气在正极获得电子生成氢氧根离子,正极电极反应式为:2H2O+4e-+O2=4OH-,
故答案为:2H2O+4e-+O2=4OH-;
(2)若乙是难溶于水的酸性氧化物,则乙为SiO2,结合转化关系可知,丙为可溶性硅酸盐、丁为H2SiO3,则:①R为Si元素,原子结构示意图为
 ,②乙为二氧化硅,可以制造光导纤维或生产玻璃等,
,②乙为二氧化硅,可以制造光导纤维或生产玻璃等,故答案为:
 ;制造光导纤维或生产玻璃等;
;制造光导纤维或生产玻璃等;(3)若丙是离子化合物,且阴离子含金属元素R,则丙为偏铝酸盐,R为Al元素,由转化关系可知,乙为Al2O3,丁为Al(OH)3,则:
①工业上电解熔融的氧化铝冶炼Al,则制取Al的单质伴随的能量主要转化形式是:电能转化为化学能,
故答案为:电;化学;
②Al的单质与MnO2反应的化学方程式为:4Al+3MnO2
| ||
故答案为:4Al+3MnO2
| ||
③染料工业排放的废水中含有大量有毒的NO2-,可以在碱性条件下加入Al的单质除去,加热处理后的废水,会产生能使湿润的红色石蕊试纸变蓝的气体,生成氨气,有丙的阴离子生成,即还生成偏铝酸根,该反应的离子方程式为:2Al+OH-+NO2-+2H2O=2AlO2-+NH3.H2O,
故答案为:2Al+OH-+NO2-+2H2O=2AlO2-+NH3.H2O.
点评:本题以无机物推断为载体,考查元素化合物性质、常用化学用语、离子方程式等,难度中等,注意对基础知识的全面掌握.

练习册系列答案
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案
相关题目
下列图示与对应的叙述不相符的是( )


| A、图1表示该可逆反应平衡后,随温度升高,平衡会逆向移动 |
| B、图2表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化 |
| C、图3表示0.1000mol?L-1NaOH溶液滴定20.00mL0.1000mol?L-1醋酸溶液所得到的滴定曲线 |
| D、图4表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的过饱和溶液 |
下列说法中正确的是.
| A、1molH2SO4与1molBa(OH)2完全中和所放出的热量为中和热 |
| B、中和反应都是放热反应 |
| C、氢气燃烧放出大量的热,说明参加反应的氢气和氧气总能量比生成物水的总能量高 |
| D、CO燃烧是吸热反应 |
对于化学作为21世纪“中心学科”的理解是错误的是( )
| A、研制具有生物功能的材料制造人工器官 |
| B、把水变成汽油解决能源短缺的问题 |
| C、寻找更好的催化剂在常温常压下合成氨 |
| D、研究生命活动的物质揭示生命现象 |


 现有浓度均为0.1mol?L-1的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、
现有浓度均为0.1mol?L-1的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、