题目内容
11.下列离子方程式书写错误的是( )| A. | NaHSO3溶液与NaOH溶液反应:HSO3-+OH-═SO32-+H2O | |
| B. | 少量二氧化碳通入足量的NaOH溶液:CO2+2OH-═CO32-+H2O | |
| C. | Ba(OH)2与H2SO4反应:H++OH-═H2O | |
| D. | 氨水和醋酸溶液混合:NH3•H2O+CH3COOH═NH4++CH3COO-+H2O |
分析 A.二者反应生成亚硫酸钠和水;
B.二氧化碳少量反应生成碳酸钠和水;
C.漏掉钡离子与硫酸根离子的反应;
D.二者反应生成醋酸铵和水.
解答 解;A.NaHSO3溶液与NaOH溶液反应,离子方程式:HSO3-+OH-═SO32-+H2O,故A正确;
B.少量二氧化碳通入足量的NaOH溶液,离子方程式:CO2+2OH-═CO32-+H2O,故B正确;
C.Ba(OH)2与H2SO4反应,离子方程式:Ba2++2H++20H-+SO42-=BaSO4↓+2H2O,故C错误;
D.氨水和醋酸溶液混合,离子方程式:NH3•H2O+CH3COOH═NH4++CH3COO-+H2O,故D正确;
故选:C.
点评 本题考查了离子方程式的书写,明确发生反应实质是解题关键,注意化学式的拆分、注意反应物用量对反应的影响.

练习册系列答案
相关题目
1.动手实践:为了更好的掌握周期表的应用,某同学在做氯、溴、碘性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象
请你帮助该同学整理并完成实验报告.
(1)实验目的:研究同主族元素性质递变规律.
(2)实验用品:试剂:氯水,溴水,NaBr溶液,KI溶液,CCl4溶液仪器:①试管,②胶头滴管.
(3)此实验的结论为氧化性的强弱顺序为:Cl2>Br2>I2.
(4)氯、溴、碘最高价氧化物对应的水化物酸性强弱(用分子式表示):HClO4>HBrO4>HIO4.
(5)氟、氯、溴、碘气态氢化物稳定性大小顺序(用分子式表示):HF>HCl>HBr>HI.
(6)该同学又做了另外一个实验,向新制得的Na2S溶液中滴加新制的氯水.该实验现象为生成淡黄色沉淀.此反应的离子方程式Cl2+S2-=S↓+2Cl-.此实验的结论为氧化性Cl2>S.
| 实验步骤 | 实验现象 |
| ①将少量的氯水滴入到适量NaBr溶液中,再滴入少量的CCl4溶液并用力振荡 | A.溶液分为上下两层,上层为无色,下层为橙红色 |
| ②将少量的溴水滴入到适量KI溶液中,再滴入少量的CCl4溶液并用力振荡 | B.溶液分为上下两层,上层为无色,下层为紫红色 |
(1)实验目的:研究同主族元素性质递变规律.
(2)实验用品:试剂:氯水,溴水,NaBr溶液,KI溶液,CCl4溶液仪器:①试管,②胶头滴管.
(3)此实验的结论为氧化性的强弱顺序为:Cl2>Br2>I2.
(4)氯、溴、碘最高价氧化物对应的水化物酸性强弱(用分子式表示):HClO4>HBrO4>HIO4.
(5)氟、氯、溴、碘气态氢化物稳定性大小顺序(用分子式表示):HF>HCl>HBr>HI.
(6)该同学又做了另外一个实验,向新制得的Na2S溶液中滴加新制的氯水.该实验现象为生成淡黄色沉淀.此反应的离子方程式Cl2+S2-=S↓+2Cl-.此实验的结论为氧化性Cl2>S.
2.t℃时,在体积不变的密闭容器中发生反应:X(g)+3Y(g)?2Z(g),各组分在不同时刻的浓度如表:
( )
( )
| 物质 | X | Y | Z |
| 初始浓度/mol•L-1 | 0.1 | 0.2 | 0 |
| 2 min末浓度/mol•L-1 | 0.08 | a | b |
| 平衡浓度/mol•L-1 | 0.05 | 0.05 | 0.1 |
| A. | 平衡时,X 的转化率为20% | |
| B. | t℃时,该反应的平衡常数为40 | |
| C. | 增大平衡后的体系压强,v正增大,v逆减小,平衡向正反应方向移动 | |
| D. | 前2 min 内,用Y 的变化量表示的平均反应速率v(Y)=0.03 mol•L-1•min-1 |
6.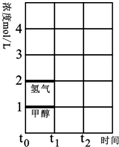 煤的气化在煤化工中占有重要地位,至今仍然是化学工业的重要组成部分.
煤的气化在煤化工中占有重要地位,至今仍然是化学工业的重要组成部分.
(1)已知H2(g)、CO(g)和CH3OH(l)的燃烧热分别为-285.8kJ•mol-1、-283.0kJ•mol -1和-726.5kJ•mol-1.请写出甲醇(CH3OH)不完全燃烧生成一氧化碳和液态水的热化学方程式:CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-443.5kJ•mol-1.
(2)工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H.下表所列数据是该反应在不同温度下的化学平衡常数(K).
①由表中数据判断△H<0 (填“>”、“=”或“<”);
②某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应后,5min达到平衡时测得c(CO)=0.2mol•L-1,此时的温度为250℃,则反应速率v(H2)=0.32 mol•L-1•min-1.
(3)T℃时,在时间t0时刻,合成甲醇反应达到平衡,若在t1时刻将容器的体积缩小一倍,假定在t2时刻后又达到新的平衡,请在图中用曲线表示在t1~t2阶段氢气、甲醇物质的量浓度随时间变化的趋势示意图(其它条件不变,曲线上必须标明氢气、甲醇).
 煤的气化在煤化工中占有重要地位,至今仍然是化学工业的重要组成部分.
煤的气化在煤化工中占有重要地位,至今仍然是化学工业的重要组成部分.(1)已知H2(g)、CO(g)和CH3OH(l)的燃烧热分别为-285.8kJ•mol-1、-283.0kJ•mol -1和-726.5kJ•mol-1.请写出甲醇(CH3OH)不完全燃烧生成一氧化碳和液态水的热化学方程式:CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-443.5kJ•mol-1.
(2)工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H.下表所列数据是该反应在不同温度下的化学平衡常数(K).
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
②某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应后,5min达到平衡时测得c(CO)=0.2mol•L-1,此时的温度为250℃,则反应速率v(H2)=0.32 mol•L-1•min-1.
(3)T℃时,在时间t0时刻,合成甲醇反应达到平衡,若在t1时刻将容器的体积缩小一倍,假定在t2时刻后又达到新的平衡,请在图中用曲线表示在t1~t2阶段氢气、甲醇物质的量浓度随时间变化的趋势示意图(其它条件不变,曲线上必须标明氢气、甲醇).
3.“纳米材料”是粒子直径为1~100nm的材料,纳米碳就是其中一种,若将纳米碳均匀地分散到( )
蒸馏水中,所形成的分散系:①是溶液 ②是胶体 ③能产生丁达尔效应 ④分散质粒子能透过滤纸 ⑤分散质粒子不能透过滤纸 ⑥静置后,会析出黑色沉淀.
蒸馏水中,所形成的分散系:①是溶液 ②是胶体 ③能产生丁达尔效应 ④分散质粒子能透过滤纸 ⑤分散质粒子不能透过滤纸 ⑥静置后,会析出黑色沉淀.
| A. | ①④⑥ | B. | ②③④ | C. | ②③⑤ | D. | ①⑤ |
11.现拟在实验室里利用空气和镁粉为原料制取少量氮化镁(Mg3N2).已知实验中可能会发生下列反应:
①2Mg+O2$\frac{\underline{\;点燃\;}}{\;}$2MgO;
②3Mg+N2$\frac{\underline{\;点燃\;}}{\;}$Mg3N2;
③2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C
④Mg+H2O$\frac{\underline{\;\;△\;\;}}{\;}$MgO+H2↑
⑤Mg3N2+6H2O═3Mg(OH)2+2NH3↑
可供选择的装置和药品如下页图所示(镁粉、还原铁粉均已干燥,装置内所发生的反应是完全的,整套装置的末端与干燥管相连).
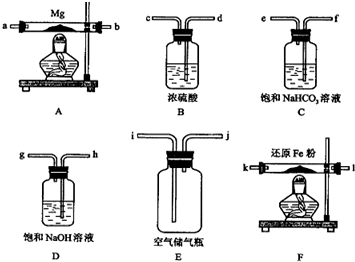
回答下列问题;
在设计实验方案时,除装置A、E外,还应选择的装置(填字母代号)及其目的分别为(可不填满)
(2)连接并检查实验装置的气密性.实验开始时,打开自来水的开关,将空气从5升的储气瓶压入反应装置,则气流流经导管的顺序是(填字母代号)j→h→g→d→c→k→l(或l→k)→a→b (或b→a);
(3)通气后,应先点燃F处的酒精灯,再点燃A处的酒精灯;如果同时点燃A、
F装置的酒精灯,对实验结果有何影响?制得的氮化镁不纯;
(4)请设计一个实验,验证产物是Mg3N2,写出操作步骤、现象和结论:将产物取少量置于试管中,加入适量水,将润湿的红色石蕊试纸置于试管口,如果能够看到润湿的红色石蕊试纸变蓝,则说明产物是氮化镁,若试纸不变蓝,则不含有Mg3N2.
①2Mg+O2$\frac{\underline{\;点燃\;}}{\;}$2MgO;
②3Mg+N2$\frac{\underline{\;点燃\;}}{\;}$Mg3N2;
③2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C
④Mg+H2O$\frac{\underline{\;\;△\;\;}}{\;}$MgO+H2↑
⑤Mg3N2+6H2O═3Mg(OH)2+2NH3↑
可供选择的装置和药品如下页图所示(镁粉、还原铁粉均已干燥,装置内所发生的反应是完全的,整套装置的末端与干燥管相连).

回答下列问题;
在设计实验方案时,除装置A、E外,还应选择的装置(填字母代号)及其目的分别为(可不填满)
| 装置 | 目的 |
(3)通气后,应先点燃F处的酒精灯,再点燃A处的酒精灯;如果同时点燃A、
F装置的酒精灯,对实验结果有何影响?制得的氮化镁不纯;
(4)请设计一个实验,验证产物是Mg3N2,写出操作步骤、现象和结论:将产物取少量置于试管中,加入适量水,将润湿的红色石蕊试纸置于试管口,如果能够看到润湿的红色石蕊试纸变蓝,则说明产物是氮化镁,若试纸不变蓝,则不含有Mg3N2.
