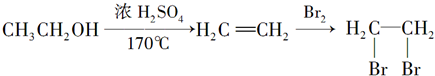题目内容
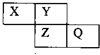 X、Y、Z、Q均为短周期元素,它们在周期表中相对位置如图所示.若X原子的最外层电子是内层电子数的2倍.下列说法中,正确的是( )
X、Y、Z、Q均为短周期元素,它们在周期表中相对位置如图所示.若X原子的最外层电子是内层电子数的2倍.下列说法中,正确的是( )| A、X与Q的化合物中不含有共价键 |
| B、最高价氧化物对应水化物的酸性:Q比Z强 |
| C、氢化物稳定性:Y比Z强 |
| D、Q与Fe反应生成的化合物中,铁元素显+3价 |
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:X、Y、Z、Q均为短周期元素,根据它们在周期表中的位置知,X、Y位于第二周期,Z和Q属于第三周期,若X原子的最外层电子是内层电子数的2倍,则X最外层有4个电子,为C元素,则Y为N元素、Z为P元素、Q为S元素,
A.X是C元素、Q是S元素,二者形成的化合物是CS2,非金属元素之间易形成极性键;
B.元素的非金属性越强,其最高价氧化物的水化物酸性越强,但O、F元素除外;
C.元素的非金属性越强,且气态氢化物的稳定性越强;
D.Q为S元素,具有弱氧化性,能将变价金属氧化为较低价态.
A.X是C元素、Q是S元素,二者形成的化合物是CS2,非金属元素之间易形成极性键;
B.元素的非金属性越强,其最高价氧化物的水化物酸性越强,但O、F元素除外;
C.元素的非金属性越强,且气态氢化物的稳定性越强;
D.Q为S元素,具有弱氧化性,能将变价金属氧化为较低价态.
解答:
解:X、Y、Z、Q均为短周期元素,根据它们在周期表中的位置知,X、Y位于第二周期,Z和Q属于第三周期,若X原子的最外层电子是内层电子数的2倍,则X最外层有4个电子,为C元素,则Y为N元素、Z为P元素、Q为S元素,
A.X是C元素、Q是S元素,二者形成的化合物是CS2,非金属元素之间易形成极性键,所以CS2分子中S原子和C原子之间存在极性键,故A错误;
B.元素的非金属性越强,其最高价氧化物的水化物酸性越强,但O、F元素除外,非金属性S>P,所以最高价氧化物的水化物酸性Q比Z强,故B正确;
C.元素的非金属性越强,且气态氢化物的稳定性越强,非金属性N>P,所以氢化物稳定性:Y比Z强,故C正确;
D.Q为S元素,具有弱氧化性,能将变价金属氧化为较低价态,所以S与Fe反应生成的化合物中,铁元素显+2价,为FeS,故D错误;
故选BC.
A.X是C元素、Q是S元素,二者形成的化合物是CS2,非金属元素之间易形成极性键,所以CS2分子中S原子和C原子之间存在极性键,故A错误;
B.元素的非金属性越强,其最高价氧化物的水化物酸性越强,但O、F元素除外,非金属性S>P,所以最高价氧化物的水化物酸性Q比Z强,故B正确;
C.元素的非金属性越强,且气态氢化物的稳定性越强,非金属性N>P,所以氢化物稳定性:Y比Z强,故C正确;
D.Q为S元素,具有弱氧化性,能将变价金属氧化为较低价态,所以S与Fe反应生成的化合物中,铁元素显+2价,为FeS,故D错误;
故选BC.
点评:本题考查位置结构性质的相互关系及应用,明确物质结构、元素周期律内涵即可解答,熟练掌握原子结构、元素周期表结构及物质性质,题目难度不大.

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
已知同温同压下,下列反应的焓变和平衡常数分别表示为
H2(g)+
O2(g)=H2O(g)△H1 K1
N2(g)+O2(g)=NO2(g)△H2 K2
N2(g)+
H2(g)=NH3(g)△H3 K3
则反应2NH3(g)+
O2(g)=2NO2(g)+3H2O(g)的△H和K分别为( )
H2(g)+
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
则反应2NH3(g)+
| 7 |
| 2 |
| A、2△H1+2△H2-2△H3 3K1+2K2-2K3 | ||||||||
B、2△H3-3△H1-2△H2
| ||||||||
C、3△H1+2△H2-2△H3
| ||||||||
| D、3△H1+2△H2-2△H3 3K1+2K2-2K3 |
不另用任何试剂就能将下列四种溶液:①CuCl2、②NH4Cl、③KCl、④NaOH、鉴别出来,其正确的鉴别顺序是( )
| A、①②④③ | B、④③②① |
| C、①④②③ | D、①②③④ |


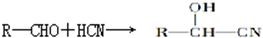 ,②R-CN
,②R-CN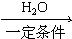 R-COOH
R-COOH 制备高分子化合物
制备高分子化合物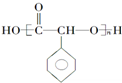 的合成路线流程图
的合成路线流程图