题目内容
2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ?mol-1.请回答下列问题:
(1)图中A表示 ,E的大小对该反应的反应热 (填“有”或“无”)影响.该反应通常用V2O5作催化剂,加V2O5会使图中B点 (填“升高”还是“降低”),△H (填“变大”、“变小”或“不变”),理由是
(2)已知单质硫的燃烧热为296KJ?mol-1,计算由S(s)生成3molSO3(g)的△H(要求计算过程).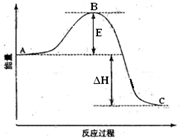
(1)图中A表示
(2)已知单质硫的燃烧热为296KJ?mol-1,计算由S(s)生成3molSO3(g)的△H(要求计算过程).

考点:有关反应热的计算,化学反应的能量变化规律
专题:
分析:(1)A表示反应物总能量,B为活化能,活化能的大小与反应热无关;C表示生成物总能量,催化剂能够降低反应的活化能,不影响反应物和生成物能量高低;
(2)依据燃烧热的概念和热化学方程式,结合盖斯定律计算得到.
(2)依据燃烧热的概念和热化学方程式,结合盖斯定律计算得到.
解答:
解:(1)A表示反应物总能量,B为活化能,C表示生成物总能量,反应热可表示为A、C活化能的大小之差,活化能的大小与反应热无关,加入催化剂,活化能减小,反应的反应热不变;该反应通常用V2O5作催化剂,催化剂改变反应速率,降低反应的活化能,改变反应历程,但不改变化学平衡,不能改变反应物的总能量和生成物的总能量之差,即不改变反应热,所加V2O5会使图中B点降低,
故答案为:反应物总能量;无影响;降低;不变;因为催化剂可以降低反应的活化能,但不能改变反应物的总能量和生成物的总能量之差,即不改变反应热;
(2)单质硫的燃烧热为296kJ?mol-1,热化学方程式为:①S(s)+O2(g)=SO2(g)△H1=-296 KJ?mol-1,已知1mol SO2(g)氧化为1mol SO3的△H=-99kJ?mol-1.热化学方程式为②SO2(g)+
O2(g)?SO3(g)△H2=-99 KJ?mol-1 ;依据盖斯定律,②+①得到:③S(s)+
O2(g)=SO3(g)△H=(△H1+△H2)KJ/mol═-395KJ?mol-1;计算由S(s)生成3molSO3(g)③×3得到:3S(s)+
O2(g)=3SO3(g)△H=3(△H1+△H2)=-1185 KJ?mol-1,
答:3S(s)+
O2(g)=3SO3(g)△H=-1185 KJ?mol-1;
故答案为:反应物总能量;无影响;降低;不变;因为催化剂可以降低反应的活化能,但不能改变反应物的总能量和生成物的总能量之差,即不改变反应热;
(2)单质硫的燃烧热为296kJ?mol-1,热化学方程式为:①S(s)+O2(g)=SO2(g)△H1=-296 KJ?mol-1,已知1mol SO2(g)氧化为1mol SO3的△H=-99kJ?mol-1.热化学方程式为②SO2(g)+
| 1 |
| 2 |
| 3 |
| 2 |
| 9 |
| 2 |
答:3S(s)+
| 9 |
| 2 |
点评:本题考查反应过程的能量变化图以及运用盖斯定律进行反应热的计算,难度不大,注意活化能与反应热的关系.

练习册系列答案
相关题目
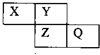 X、Y、Z、Q均为短周期元素,它们在周期表中相对位置如图所示.若X原子的最外层电子是内层电子数的2倍.下列说法中,正确的是( )
X、Y、Z、Q均为短周期元素,它们在周期表中相对位置如图所示.若X原子的最外层电子是内层电子数的2倍.下列说法中,正确的是( )| A、X与Q的化合物中不含有共价键 |
| B、最高价氧化物对应水化物的酸性:Q比Z强 |
| C、氢化物稳定性:Y比Z强 |
| D、Q与Fe反应生成的化合物中,铁元素显+3价 |
下列物质与其用途相符合的是( )
①Cl2-做消毒剂
②AgBr-制胶卷、感光纸
③AgI-人工降雨
④碘酸钾-制作加碘盐
⑤淀粉-检验I2的存在
⑥CaCl2-漂白纺织物.
①Cl2-做消毒剂
②AgBr-制胶卷、感光纸
③AgI-人工降雨
④碘酸钾-制作加碘盐
⑤淀粉-检验I2的存在
⑥CaCl2-漂白纺织物.
| A、②③④⑤⑥ | B、①②③④⑤ |
| C、②③④⑤ | D、全部 |
关于小苏打水溶液的表述正确的是( )
| A、HCO3-的电离程度大于HCO3-的水解程度 |
| B、c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3) |
| C、c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) |
| D、存在的电离有:NaHCO3=Na++HCO3-,HCO3-?H++CO32-,H2O?H++OH-,HCO3-+H2O?H2CO3+OH |
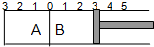 如图所示,温度不变的某容器分隔成A、B两部分,A容器容积固定不变,B有可移动的活塞,现在A中充入2molSO2和1molO2,在B中充入2molSO3和1molN2,在相同条件下发生可逆反应:2SO2(g)+O2(g)?2SO3(g),
如图所示,温度不变的某容器分隔成A、B两部分,A容器容积固定不变,B有可移动的活塞,现在A中充入2molSO2和1molO2,在B中充入2molSO3和1molN2,在相同条件下发生可逆反应:2SO2(g)+O2(g)?2SO3(g),