题目内容
已知同温同压下,下列反应的焓变和平衡常数分别表示为
H2(g)+
O2(g)=H2O(g)△H1 K1
N2(g)+O2(g)=NO2(g)△H2 K2
N2(g)+
H2(g)=NH3(g)△H3 K3
则反应2NH3(g)+
O2(g)=2NO2(g)+3H2O(g)的△H和K分别为( )
H2(g)+
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
则反应2NH3(g)+
| 7 |
| 2 |
| A、2△H1+2△H2-2△H3 3K1+2K2-2K3 | ||||||||
B、2△H3-3△H1-2△H2
| ||||||||
C、3△H1+2△H2-2△H3
| ||||||||
| D、3△H1+2△H2-2△H3 3K1+2K2-2K3 |
考点:反应热和焓变
专题:化学反应中的能量变化
分析:根据盖斯定律进行计算,由①×3-③×2+②×2得出2NH3(g)+
O2(g)=2NO2(g)+3H2O(g)的△H;根据平衡常数的表达式得出K与系数成幂次方关系,方程式相加即平衡常数相乘,方程式相减即平衡常数相除,以此分析;
| 7 |
| 2 |
解答:
解:已知同温同压下,下列反应的焓变和平衡常数分别表示为
①H2(g)+
O2(g)=H2O(g)△H1 K1
②
N2(g)+O2(g)=NO2(g)△H2 K2
③
N2(g)+
H2(g)=NH3(g)△H3 K3
则2NH3(g)+
O2(g)=2NO2(g)+3H2O(g)由①×3-③×2+②×2得到,所以△H=3△H1+2△H2-2△H3;
根据平衡常数K与系数成幂次方关系,方程式相加即平衡常数相乘,方程式相减即平衡常数相除,又由2NH3(g)+
O2(g)=2NO2(g)+3H2O(g)由①×3-③×2+②×2得到,则K=
;故选:C;
①H2(g)+
| 1 |
| 2 |
②
| 1 |
| 2 |
③
| 1 |
| 2 |
| 3 |
| 2 |
则2NH3(g)+
| 7 |
| 2 |
根据平衡常数K与系数成幂次方关系,方程式相加即平衡常数相乘,方程式相减即平衡常数相除,又由2NH3(g)+
| 7 |
| 2 |
| K 1 3K 2 2 |
| K 3 2 |
点评:本题主要考查了盖斯定律的应用及其平衡常数的转换关系,难度不大,需要细心计算即可;

练习册系列答案
相关题目
NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒,已知NaNO2能发生如下反应:2NaNO2+4HI═2NO↑+I2+2NaI+2H2O.下列说法正确的是( )
| A、NaNO2在反应中被氧化 |
| B、NaI是还原产物 |
| C、若反应过程中转移2mole-,则生成标准状况下NO的体积为44.8L |
| D、氧化剂与还原剂之比为1:2 |
下列有关化学用语表示正确的是( )
| A、乙烯的结构简式:CH2CH2 |
B、羟基的电子式: |
C、甲烷分子的比例模型: |
D、乙醇的结构式: |
在一定温度下,向饱和的烧碱溶液中放入一定量的过氧化钠,充分反应后恢复到原温度,下列说法正确的是( )
| A、溶液中的Na+浓度增大,有O2放出 |
| B、溶液中的OH- 浓度不变,有H2放出 |
| C、溶液中的Na+数目减少,有O2放出 |
| D、溶液中的OH-浓度增大,有O2放出 |
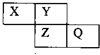 X、Y、Z、Q均为短周期元素,它们在周期表中相对位置如图所示.若X原子的最外层电子是内层电子数的2倍.下列说法中,正确的是( )
X、Y、Z、Q均为短周期元素,它们在周期表中相对位置如图所示.若X原子的最外层电子是内层电子数的2倍.下列说法中,正确的是( )| A、X与Q的化合物中不含有共价键 |
| B、最高价氧化物对应水化物的酸性:Q比Z强 |
| C、氢化物稳定性:Y比Z强 |
| D、Q与Fe反应生成的化合物中,铁元素显+3价 |