题目内容
8.设NA为阿伏加德罗常教,下列叔述正确的是( )| A. | 常温常压下,9.2gNO2气体中.分子数为0.2NA | |
| B. | pH=2的硫酸溶液中,H+数目为0.01NA | |
| C. | 将0.05molFeCl3全部转化为Fe(OH)3胶体,则胶粒数目为0.05NA | |
| D. | 20gD2O中含有的质子数为10NA |
分析 A.NO2物质的量=$\frac{9.2g}{46g/mol}$=0.2mol,二氧化氮聚合生成四氧化二氮;
B.溶液体积不知不能计算微粒数;
C.1个Fe(OH)3胶粒是多个Fe(OH)3分子的聚集体;
D.D2O的摩尔质量为20g/mol,含有10个质子.
解答 解:A.NO2物质的量=$\frac{9.2g}{46g/mol}$=0.2mol,二氧化氮聚合生成四氧化二氮,分子数小于0.2NA ,故A错误;
B.pH=2的硫酸溶液中氢离子浓度为0.01mol/L,溶液体积不知不能计算氢离子数,故B错误;
C.将0.05molFeCl3全部转化为Fe(OH)3胶体,则胶粒数目小于0.05NA,故C错误;
D.D2O的摩尔质量为20g/mol,故20g重水的物质的量n=$\frac{20g}{20g/mol}$=1mol,而1mol重水中含10mol质子,故1mol重水中含10mol质子即10NA个,故D正确;
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,题目难度不大.

练习册系列答案
相关题目
16.下列说法中,正确的是( )
| A. | 化合物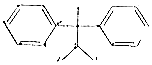 是苯的同系物 是苯的同系物 | |
| B. | 有机物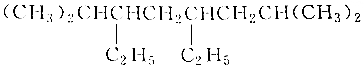 的系统名称是2-甲基-4-乙基-6-异丙基辛烷 的系统名称是2-甲基-4-乙基-6-异丙基辛烷 | |
| C. | C4H8的同分异构体只有3种 | |
| D. | 液化石油气的主要成分是烃,它是一种清洁燃料 |
19.下列关于有机物X(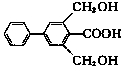 )的说法正确的是.
)的说法正确的是.
 )的说法正确的是.
)的说法正确的是.| A. | 分子式为C15H19O4 | |
| B. | 苯环上的一氯代物有7种 | |
| C. | 能发生氧化反应和取代反应 | |
| D. | 1molX与足量的NaOH溶液反应,最多消耗3molNaOH |
16.下列指定反应的离子方程式正确的是( )
| A. | 向 H2O中通人 NO2:3NO2+H2O═H++NO3-+2NO | |
| B. | 向Na2SiO3溶液中通入少量SO2:Na2SiO3+SO2+H2O═H2SiO3↓+2Na++SO32- | |
| C. | 用饱和纯減溶液洗涤试管中残留的苯酚:CO32-+2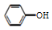 →2 →2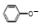 +CO2↑+H2O +CO2↑+H2O | |
| D. | 等体积等物质的量浓度的NH4Fe(SO4)2和Ba(OH)2混合:2Fe3++3SO42-+3Ba2++6OH-═3BaSO4↓+2Fe(OH)3↓ |
3.下列有关物质的性质与用途具有对应关系的是( )
| A. | 石英坩埚耐高温,可用来加热熔化烧碱、纯碱等固体 | |
| B. | Al具有良好的延展性和抗腐蚀性,常用铝箔包装物品 | |
| C. | 浓H2SO4溶液能使蛋白质发生盐析,可用于杀菌消毒 | |
| D. | 铜的金属活动性比铁的弱,可在海外轮外壳上装若干铜块以减缓其腐蚀 |
13.下列有关卤族元素及其化合物的表示正确的是( )
| A. | 氟离子的结构示意图: | |
| B. | 次氯酸分子的电子式: | |
| C. | 2,4,6-三溴苯酚的结构简式: | |
| D. | 质子数为53,中子数为78的碘原子:5378I |
20.25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 0.1mol/L NaHSO4溶液中:K+、AlO2-、Cl-、CH3COO- | |
| B. | 0.1mol/L NaHCO3溶液中:Al3+、Ca2+、SO42-、NO3- | |
| C. | 0.1mol/L FeCl3溶液中:NH4+、NO3-、Na+、SO42 | |
| D. | 0.1mol/L H2O2溶液中:Na+、K+、SO42-、I- |
17.根据下列实验操作和现象所得到的结论正确的是( )
| 选项 | 实验操作和现象 | 结论 |
| A | 在酒精灯上加热铝箔,铝箔熔化但不滴落 | 熔点:铝>氧化铝 |
| B | 向某溶液中先滴加KSCN溶液,再滴加少量氯水,先无明显现象,后溶液变成血红色 | 原溶液中含有Fe3+,没有Fe2- |
| C | KNO3和KOH混合溶液中加入铝粉并加热,管口放湿润的红色石蕊试纸,试纸变为蓝色 | NO3-还原为NH3 |
| D | 向加入了几滴酚酞试液的Na2CO3溶液中滴加BaCl2溶液,红色逐渐褪去 | Na2CO3溶液中存在水解平衡 |
| A. | A | B. | B | C. | C | D. | D |
9.下列指定反应的离子方程式正确的是( )
| A. | 碳酸钠溶液中滴加等物质的量的乙酸:CO32-+2CH3COOH═CO2↑+H2O+2CH3COO- | |
| B. | 用氨水吸收少量的二氧化硫:2NH3•H2O+SO2═2NH4++SO32-+H2O | |
| C. | NaHSO4溶液中加Ba(OH)2溶液至中性:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | Fe (NO3)3溶液中加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 |